题目内容
11.X、Y、Z、W是原子序数依次增大的三个不同短周期主族元素.X、W均为所在周期数和族序数相等的元素.Y、Z易形成质量比为7:8和7:16的两种常见化合物.下列说法正确的是( )| A. | 原子半径:Y<Z<W | |
| B. | 原子最外层电子数:W>Z>Y | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 由X、Y、Z三种元素形成的化合物的水溶液一定显酸性 |
分析 X、Y、Z、W是原子序数依次增大的三个不同短周期主族元素.X、W均为所在周期数和族序数相等的元素,则X为H,W为Al;Y、Z易形成质量比为7:8和7:16的两种常见化合物,Y为N,Z为O,形成化合物为NO、NO2,以此来解答.
解答 解:由上述分析可知,X为H,Y为N,Z为O,W为Al,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Z<Y<W,故A错误;
B.原子最外层电子数:Z>Y>W,故B错误;
C.X、Y可以形成既有极性键也有非极性键的化合物,如N2H4,故C正确;
D.由X、Y、Z三种元素形成的化合物为硝酸或硝酸铵时,水溶液显酸性,为一水合氨时显碱性,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
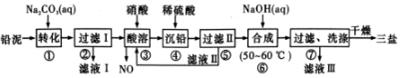
1.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表: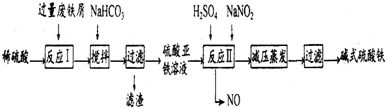
回答下列问题:
(1)反应I溶液中存在的金属阳离子有Fe2+、Al3+.
(2)加入NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”、“Fe2+”或“A13+”)沉淀.该工艺流程中“搅拌”的作用是加快反应速率.
(3)反应II的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成${[{F{e_2}{{({OH})}_4}}]^{2+}}$聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I溶液中存在的金属阳离子有Fe2+、Al3+.
(2)加入NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”、“Fe2+”或“A13+”)沉淀.该工艺流程中“搅拌”的作用是加快反应速率.
(3)反应II的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成${[{F{e_2}{{({OH})}_4}}]^{2+}}$聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
2.下列有关工业生产的叙述中正确的是( )
| A. | 硫酸工业中,为了提高SO2的转化率,使用五氧化二钒作催化剂 | |
| B. | 合成氨中通过及时分离液态氨来提高化学反应速率 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| D. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
19.将过量的CO2分别通入
①CaCl2溶液
②Na2SiO3溶液
③Ca(ClO)2溶液
④饱和Na2CO3溶液
⑤NaAlO2 最终有沉淀析出的是( )
①CaCl2溶液
②Na2SiO3溶液
③Ca(ClO)2溶液
④饱和Na2CO3溶液
⑤NaAlO2 最终有沉淀析出的是( )
| A. | ②④⑤ | B. | ①②③④ | C. | ②③④⑤ | D. | ②③④ |
6.向恒温恒容的密闭容器中充入amolX和bmolY,发生反应X(g)+3Y(g)?2Z(g)达到平衡时,测得X和Y的转化率分别为25%和37.5%.则a:b为( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 1:2 |
3. 一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )
一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )
 一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )
一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )| A. | 1种 | B. | 2种 | C. | 4种 | D. | 6种 |
20.下列实验误差分析不正确的是( )
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
1.从滴定管中滴下1滴溶液的体积接近( )
| A. | 0.5mL | B. | 0.1mL | C. | 0.05mL | D. | 0.01mL |