题目内容
4.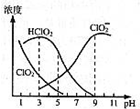 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | “有效氯含量”可用来衡量含氯消毒剂的消毒能力,指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,则NaClO2的有效氯含量约为1.57 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
分析 A.由图可以得出:碱性条件下ClO2-浓度高;
B.结合转移电子计算有效氯含量;
C.HClO2和ClO2都具有漂白作用,pH越小,其含量越高;
D.pH=3时,溶液含氯离子,电荷守恒式为c(H+)+c(Na+)=c(ClO2-)+c(OH-)+c(Cl-).
解答 解:A.由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B.消毒剂的消毒是基于物质的氧化性,1mol氯气得电子2mol,1mol亚氯酸钠得电子4mol,NaClO2的有效氯含量约为$\frac{\frac{1g}{129.5g/mol}×4}{\frac{1g}{71g/mol}×2}$×100%=1.1,故B错误;
C.HClO2和ClO2都具有漂白作用,pH越小,其含量越高,则pH越小,该漂白剂的漂白性能越好,故C错误;
D.若没有氯离子,依据电中性原则可得c(H+)+c(Na+)=c(ClO2-)+c(OH-),但溶液中含有氯离子其浓度变化没有画出,故D错误;
故选A.
点评 本题考查离子浓度大小的比较,为高频考点,把握图中离子浓度的变化、电荷守恒为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
6.化学与生产、生活密切相关.下列叙述不正确的是( )
| A. | PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因 | |
| B. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:灼烧→浸泡→过滤→萃取→粗碘提纯 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不同 |
19.t℃时,相对分子质量为A的某物质的饱和溶液,其物质的量浓度为Bmol•L-1,密度为ρg•cm-3,则该物质在t℃时溶解度为( )
| A. | $\frac{100AB}{1000ρ-AB}$g | B. | $\frac{AB}{1000ρ-AB}×100%$g | ||
| C. | $\frac{AB}{100ρ}×100$g | D. | $\frac{100AB}{ρ-AB}$g |
9.已知如下热化学方程式:Ca(s)+Cl2(g)→CaCl2(s)+795kJ;Sr(s)+Cl2(g)→SrCl2(s)+828kJ;Ba(s)+Cl2(g)→BaCl2(s)+860kJ;则①CaCl2;②SrCl2;③BaCl2三种氯化物的稳定性由大到小的排列为( )
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
16.下列操作中错误的是( )
| A. | 除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液 | |
| B. | 除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥 | |
| C. | 除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶 | |
| D. | 提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离 |
14.硫代硫酸钠(Na2S2O3)俗称保险粉,可用作照相定影剂、纸浆漂白脱氯剂等.
(1)实验室可通过反应2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2制取Na2S2O3,装置如图所示.
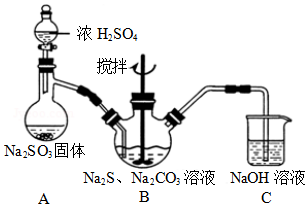
装置B中搅拌器的作用是让反应物充分反应(或反应物充分混合或加快反应速度);装置C中NaOH溶液的作用是吸收二氧化硫尾气,防止空气污染.
(2)请对上述装置提出一条优化措施A中分液漏斗改为恒压漏斗(或者BC之间添加一个安全瓶防倒吸).
为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,称取3.000g Na2S2O3•5H2O样品配成100mL溶液,用0.100mol/L标准碘溶液进行滴定,反应方程式为:2Na2S2O3+I2→2NaI+Na2S4O6
(3)滴定时用淀粉作指示剂,滴定时使用的主要玻璃仪器有滴定管、锥形瓶.
(5)滴定时,若看到溶液局部变色就停止滴定,则样品中Na2S2O3•5H2O的质量分数测定值偏低(填“偏高”、“偏低”或“不变”).
(5)某学生小组测得实验数据如表:
该样品中Na2S2O3•5H2O的质量分数是0.814.(精确到0.001)
(1)实验室可通过反应2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2制取Na2S2O3,装置如图所示.

装置B中搅拌器的作用是让反应物充分反应(或反应物充分混合或加快反应速度);装置C中NaOH溶液的作用是吸收二氧化硫尾气,防止空气污染.
(2)请对上述装置提出一条优化措施A中分液漏斗改为恒压漏斗(或者BC之间添加一个安全瓶防倒吸).
为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,称取3.000g Na2S2O3•5H2O样品配成100mL溶液,用0.100mol/L标准碘溶液进行滴定,反应方程式为:2Na2S2O3+I2→2NaI+Na2S4O6
(3)滴定时用淀粉作指示剂,滴定时使用的主要玻璃仪器有滴定管、锥形瓶.
(5)滴定时,若看到溶液局部变色就停止滴定,则样品中Na2S2O3•5H2O的质量分数测定值偏低(填“偏高”、“偏低”或“不变”).
(5)某学生小组测得实验数据如表:
| 实验次数 | 样品溶液体积(mL) | 滴定消耗0.100mol/L碘溶液体积(mL) |
| 1 | 20.00 | 9.80 |
| 2 | 20.00 | 10.70 |
| 3 | 20.00 | 9.90 |
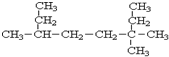 3,3,6-三甲基辛烷
3,3,6-三甲基辛烷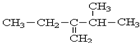 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯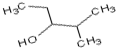 2-甲基-3-戊醇.
2-甲基-3-戊醇.