题目内容
13.将银合金试样用HNO3溶解,配制成250.00mL溶液,滴定25.00mL制得的溶液时,消耗了同样体积的c(NH4SCN)=0.05000mol/L的NH4SCN溶液.问此含银为82%的合金为多少克?分析 据AgNO3+NH4SCN=AgSCN↓+NH4NO3此方程式中NH4SCN的量,求AgNO3的量,并根据元素守恒求银的量,并据m(合金)=$\frac{m}{W}$,据此进行分析.
解答 解:n(NH4SCN)=0.05000mol/L×0.02500L=0.00125mol,
AgNO3+NH4SCN=AgSCN↓+NH4NO3
1 1
0.00125 0.00125
则:n(AgNO3)=0.00125mol,根据Ag元素守恒,n(Ag)=n(AgNO3)=0.00125mol,故250ml中Ag的物质的量为n总(Ag)=0.00125mol×$\frac{250ml}{25ml}$=0.0125mol,m(Ag)=n总(Ag)M=0.0125mol×108g/mol=1.35g,
故m(合金)=$\frac{1.35g}{82%}$=1.64634g,
答:含银为82%的合金为1.64634g.
点评 本题考查混合物中含量的测定,正确书写方程式是本题解题的关键,本题题目难度中等.

练习册系列答案
相关题目
3.设NA为阿伏伽德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,1.7g NH3所含的电子数为0.8NA | |
| B. | 标准状况下,11.2L SO2所含的氧原子数为1.5NA | |
| C. | 1mol Fe与足量的稀硝酸反应,转移的电子总数为3NA | |
| D. | 0.1mol•L-1的Na2CO3溶液中含有的钠离子数为0.2NA |
4.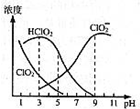 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | “有效氯含量”可用来衡量含氯消毒剂的消毒能力,指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,则NaClO2的有效氯含量约为1.57 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
18.化学与环境、材料、信息、能源关系密切,下列说法中不正确的是( )
| A. | 高铁酸钾(K2FeO4)是一种新型高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 用SO2漂白纸浆和草帽辫,该过程利用了SO2的氧化性 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
5.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向淀粉NaI溶液中加入氯水 | 溶液变蓝 | 氧化性:C12>I2 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| A. | A | B. | B | C. | C | D. | D |
2.只表示一种微粒的化学用语是( )
| A. |  | B. | X:X | C. | ns1 | D. | X-X |
12.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如表:
请回答下列问题:
(1)第二次实验中产生沉淀的质量是5.516g;
(2)求所用Ba(OH)2的溶液的物质的量浓度0.112 g•mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比5:2;
(4)在25℃时,取下第3组实验所得溶液体积的$\frac{1}{10}$,加水配成1000mL溶液,求此溶液pH=12.
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 1.716 | 0.5 | 2.758 |
| 2 | 3.432 | 0.5 | |
| 3 | 5.148 | 0.5 | 8.274 |
| 4 | 6.864 | 0.5 | 11.032 |
| 5 | 8.580 | 0.5 | 11.032 |
| 6 | 10.296 | 0.5 | 11.032 |
(1)第二次实验中产生沉淀的质量是5.516g;
(2)求所用Ba(OH)2的溶液的物质的量浓度0.112 g•mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比5:2;
(4)在25℃时,取下第3组实验所得溶液体积的$\frac{1}{10}$,加水配成1000mL溶液,求此溶液pH=12.