题目内容
9.已知如下热化学方程式:Ca(s)+Cl2(g)→CaCl2(s)+795kJ;Sr(s)+Cl2(g)→SrCl2(s)+828kJ;Ba(s)+Cl2(g)→BaCl2(s)+860kJ;则①CaCl2;②SrCl2;③BaCl2三种氯化物的稳定性由大到小的排列为( )| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
分析 由热化学方程式可知,金属与氯气反应为放热反应,且金属越活泼放出的热量越多,生成金属氯化物越稳定,以此来解答.
解答 解:由Ca(s)+Cl2(g)→CaCl2(s)+795kJ、Sr(s)+Cl2(g)→SrCl2(s)+828kJ、Ba(s)+Cl2(g)→BaCl2(s)+860kJ可知,BaCl2最稳定,则三种金属氯化物的稳定性由大到小的顺序为③②①,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、稳定性与能量的关系为解答的关键,侧重分析与应用能力的考查,注意放出热量越多生成氯化物的能量越低,题目难度不大.

练习册系列答案
相关题目
20.下列曲线图(纵坐标为沉淀的物质的量,横坐标为加入物的量)不正确的是( )
| A. | 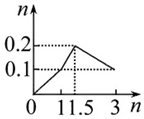 向1 L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L-1稀硫酸 | |
| B. |  向1 L含有0.1 mol•L-1 AlCl3和0.3 mol•L-1 NH4Cl的混合液中加入0.1 mol•L-1 NaOH溶液 | |
| C. |  向烧碱溶液滴加明矾溶液 | |
| D. | 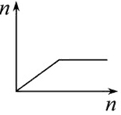 向AlCl3溶液滴加过量氨水 |
17.在标准状况下,将a L HCl(气)溶于1L水中(水的密度为1g•cm-3),得到的盐酸的密度为b g•mL-1,质量分数为w,物质的量浓度为c mol•L-1则下列关系式中不正确的是( )
| A. | w=$\frac{36.5a}{(36.5a+22400)}$ | B. | w=$\frac{36.5c}{1000b}$ | ||
| C. | C=$\frac{1000ab}{(36.5a+22400)}$ | D. | b=$\frac{(36.5a+22400)}{(a+1)}$ |
4.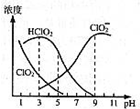 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | “有效氯含量”可用来衡量含氯消毒剂的消毒能力,指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,则NaClO2的有效氯含量约为1.57 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
18.化学与环境、材料、信息、能源关系密切,下列说法中不正确的是( )
| A. | 高铁酸钾(K2FeO4)是一种新型高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 用SO2漂白纸浆和草帽辫,该过程利用了SO2的氧化性 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
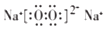 (用电子式表示).
(用电子式表示).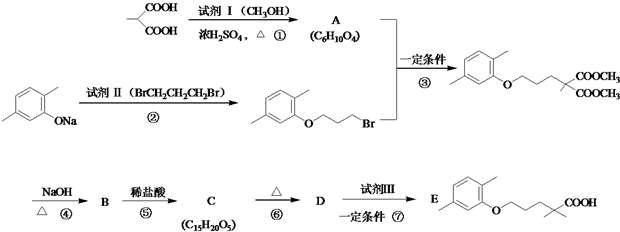
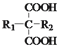 $\stackrel{△}{→}$
$\stackrel{△}{→}$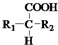 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)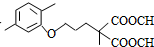 $\stackrel{△}{→}$
$\stackrel{△}{→}$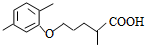 +CO2↑.
+CO2↑.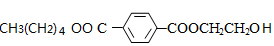 ,则X与Y发生缩聚反应所得缩聚物的结构简式是
,则X与Y发生缩聚反应所得缩聚物的结构简式是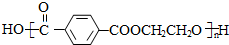 .
.