题目内容
1.在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与反应).某化学研究学习小组对硫铁矿样品进行如下实验探究:【实验一】测定硫元素的含量
Ⅰ.实验装置如下图所示(夹持和加热装置已省略).A中的试剂是双氧水,将m1g该硫铁矿样品放人硬质玻璃管D中.从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全.
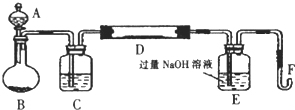
Ⅱ.反应结束后,将E瓶中的溶液进行如下处理:
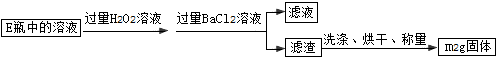
【实验二】测定铁元素的含量
Ⅲ.测定铁元素含量的实验步骤如下:
①%2足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②%2②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤
液B;
③将滤液B稀释为250mL;
④取稀释液25.00mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL.
请根据以上实验,回答下列问题:
(1)Ⅰ中装置A仪器名称为分液漏斗;B仪器名称为圆底烧瓶.
(2)Ⅰ中装置C中盛装的试剂是浓硫酸;E瓶的作用是吸收二氧化硫.
(3)Ⅱ中加入过量H2O2溶液发生反应的离子方程式为H2O2+SO32-═SO42-+H2O.
(4)Ⅲ的步骤③中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是250mL容量瓶;滴定终点的标志是当滴入最后一滴酸性KMnO4标准液时,溶液出现浅红色,且30S内不复原.
(5)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%.(用含m1和m2的代数式表示)
分析 (1)根据装置图可知A、B仪器的名称;
(2)装置中生成的氧气含有水蒸气需要在通入玻璃管前除去水蒸气,选用浓硫酸进行干燥;铁矿石和氧气反应生成氧化铁和二氧化硫,E装置是吸收二氧化硫气防止污染环境;
(3)Ⅱ中加入过量H2O2溶液发生的反应是过氧化氢氧化亚硫酸根离子生成硫酸根离子,过氧化氢被还原为水;
(4)依据配制一定体积溶液的操作步骤分析,需要在250mL容量瓶中配制,滴定终点时溶液会出现浅红色;
(5)样品质量为m1g,依据流程分析可知得到硫酸钡沉淀为m2g,依据硫元素守恒计算硫元素质量得到硫元素的质量分数;
解答 解:(1)根据装置图可知A仪器的名称为分液漏斗,B仪器的名称为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)装置中生成的氧气含有水蒸气需要在通入玻璃管前除去水蒸气,选用浓硫酸进行干燥;铁矿石和氧气反应生成氧化铁和二氧化硫,E装置是吸收二氧化硫气防止污染环境;
故答案为:浓硫酸;吸收二氧化硫;
(3)Ⅱ中加入过量H2O2溶液发生的反应是过氧化氢氧化亚硫酸根离子生成硫酸根离子,过氧化氢被还原为水,反应的离子方程式为:H2O2+SO32-═SO42-+H2O;
故答案为:H2O2+SO32-═SO42-+H2O;
(4)依据配制一定体积溶液的操作步骤分析,需要在250mL容量瓶中配制,滴定终点的标志是当滴入最后一滴酸性KMnO4标准液时,溶液出现浅红色,且30S内不复原,
故答案为:250mL容量瓶;当滴入最后一滴酸性KMnO4标准液时,溶液出现浅红色,且30S内不复原;
(5)样品质量为m1g,依据流程分析可知得到硫酸钡沉淀为m2g,硫元素物质的量=硫酸钡物质的量=$\frac{m{\;}_{2}g}{233g/mol}$=$\frac{m{\;}_{2}}{233}$mol;依据硫元素守恒计算硫元素质量得到硫元素的质量分数=$\frac{\frac{m{\;}_{2}}{233}mol×32g/mol}{m{\;}_{1}g}$×100%=$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%,
故答案为:$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%.
点评 本题考查了物质性质的实验探究方法和实验分析判断,过程中的定量计算关系是解题关键,题目难度中等.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法估算 |
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | $\frac{1}{2}$lg($\frac{a}{b}$) | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
(4)在一定条件下,Cl-与R2+可形成一种无限长链离
 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”)分子,
②P的结构简式为
 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).