题目内容
10.FeCl3是一种用途比较广泛的盐.(1)印刷电路板是由高分子材料和铜箔复合而成.刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是c(填字母序号).
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可.
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为丁达尔效应.
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,请写出变蓝之前发生反应的离子方程式:
2Fe3++2I-=2Fe2++I2,当有25.4g的碘生成时转移的电子数目为2NA.向上述反应后的溶液中通入SO2气体,溶液将褪色,发生反应的离子方程式:SO2+I2+2H2O=2I-+SO42-+4H+;若改加入CCl4,振荡、静置后会发现CCl4层的颜色为紫红色,再将混合液倒入分液漏斗(填仪器名称)中,将两层液体分离.
分析 (1)反应生成氯化铜和氯化亚铁;
(2)FeCl3在沸水中可生成胶体,胶体具有丁达尔效应;
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,是由于Fe3+能将I-氧化为I2;当生成1mol碘时,转移2mol电子;向上述溶液中通入二氧化硫气体,I2能和二氧化硫反应生成硫酸和HI;若改加入四氯化碳,则四氯化碳能将I2萃取出来,所使用的主要仪器为分液漏斗.
解答 解:(1)FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,该离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)将饱和的FeCl3溶液滴入沸水中,继续煮沸至溶液变为红褐色,即可生成红褐色氢氧化铁胶体,则应选C,且胶体具有丁达尔效应,可利用此性质来证明此胶体已经制成,
故答案为:C;丁达尔效应;
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,是由于Fe3+能将I-氧化为I2,离子方程式为:2Fe3++2I-=2Fe2++I2,则生成碘能使淀粉变蓝;此反应中当生成1mol碘时,转移2mol电子,故当生成25.4g的碘即0.1mol碘时,转移0.2mol电子即0.2NA个;向上述溶液中通入二氧化硫气体,I2能和二氧化硫反应生成硫酸和HI,离子方程式为:SO2+I2+2H2O=2I-+SO42-+4H+;若改加入四氯化碳,则四氯化碳能将I2萃取出来,故四氯化碳层呈紫红色,萃取时所使用的主要仪器为分液漏斗.故答案为:
2Fe3++2I-=2Fe2++I2,0.2NA,SO2+I2+2H2O=2I-+SO42-+4H+,紫红,分液漏斗.
点评 本题考查知识点较多,涉及离子反应、胶体制备和性质、氧化还原反应、萃取和分液等,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
20.下列图示实验操作中,不正确的是( )
| A. |  滴加液体药品 | B. |  过滤 | C. | 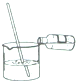 稀释浓硫酸 | D. |  读取液体的体积 |
18.下列反应的离子方程式书写正确的是( )
| A. | Na2O溶于水:Na2O+H2O=2Na++2OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
5.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| D. | SO2溶于水能导电,SO2属于电解质 |
15.关于如图各实验装置的叙述中,不正确的是( )

| A. | 装置①可用于分离乙醇和水的混合物 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
2.常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是( )
| A. | c(Ba2+)=c(SO42-) | |
| B. | c(Ba2+)增大,c (SO42-) 减小 | |
| C. | c(Ba2+)≠c SO42-),c(Ba2+)•c(SO42-)=KSP(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠KSP(BaSO4) |
19.茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )(Fe3+的检验滴加KSCN溶液)
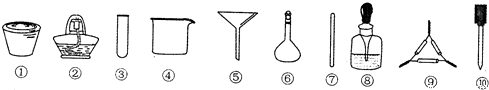

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 检验滤液中的Fe3+,选用③、⑧和⑩ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 过滤得到的滤液,选用④、⑤和⑦ |
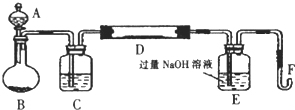
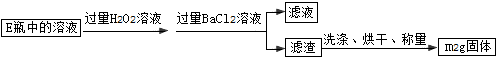
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.