题目内容
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X 的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是()
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是 (填“吸热”或“放热”)反应。

(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)500℃ K3= ;反应③△H 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)

(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
3.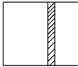 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A. | 物质A、B的转化率之比为a:b | |
| B. | 起始时刻和达平衡后容器中的压强比为(a+b):(a+b-$\frac{n}{2}$) | |
| C. | 若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C | |
| D. | 当v正(A)=2v逆(B)时,可判定反应达到平衡 |
20.下列图示实验操作中,不正确的是( )
| A. |  滴加液体药品 | B. |  过滤 | C. |  稀释浓硫酸 | D. |  读取液体的体积 |


 CH3OH(g)
CH3OH(g) [Cu(NH3)3·CO]+(aq)
[Cu(NH3)3·CO]+(aq)

 .①用硫粉覆盖地下撒有的汞②金属钠着火用泡沫灭火器或干粉灭火器扑灭③用热 碱溶液洗去试管内壁的硫④用湿的红色石蕊试纸检验氨气是否集满以上操作均合理
.①用硫粉覆盖地下撒有的汞②金属钠着火用泡沫灭火器或干粉灭火器扑灭③用热 碱溶液洗去试管内壁的硫④用湿的红色石蕊试纸检验氨气是否集满以上操作均合理 +、Fe2+、Zn2+ B.只含 Zn2+
+、Fe2+、Zn2+ B.只含 Zn2+
