题目内容
12.已知25%酒精的密度为0.91g•cm-3,5%的酒精密度为0.98g•cm-3,如果将上述两种溶液等体积混合,所得酒精的质量分数( )| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法估算 |
分析 设25%的酒精和5%的酒精的体积各取VL,根据溶质质量分数的表达式w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%进行计算.
解答 解:设25%的酒精和5%的酒精体积都为VL,
则混合后的氨水的质量分数为:w=$\frac{0.91V×25%+0.98V×5%}{0.91V+0.98V}$=14.6%<15%,
故选C.
点评 本题考查了有关溶质质量分数的简单计算,题目难度中等,注意明确:①密度比水大的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数大于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氢氧化钠、氯化钠溶液等;②密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氨水、酒精溶液等.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
3.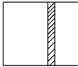 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A. | 物质A、B的转化率之比为a:b | |
| B. | 起始时刻和达平衡后容器中的压强比为(a+b):(a+b-$\frac{n}{2}$) | |
| C. | 若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C | |
| D. | 当v正(A)=2v逆(B)时,可判定反应达到平衡 |
20.下列图示实验操作中,不正确的是( )
| A. |  滴加液体药品 | B. |  过滤 | C. |  稀释浓硫酸 | D. |  读取液体的体积 |
7.茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池.在这种电池中①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应( )
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
17.将浓度为0.1mol•L-1Al2(SO4)3溶液加水稀释,下列结论错误的是( )
| A. | 水解平衡正向移动 | B. | 各微粒浓度均变小 | ||
| C. | 溶液中离子数目增多 | D. | c(Al3+)与c(SO42-)的比值减小 |
2.常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是( )
| A. | c(Ba2+)=c(SO42-) | |
| B. | c(Ba2+)增大,c (SO42-) 减小 | |
| C. | c(Ba2+)≠c SO42-),c(Ba2+)•c(SO42-)=KSP(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠KSP(BaSO4) |
 [Cu(NH3)3·CO]+(aq)
[Cu(NH3)3·CO]+(aq)
 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
