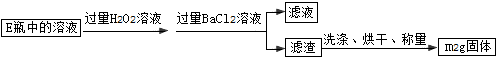
题目内容
9.(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,固体全部溶解,所发生反应的离子方程式为6H++Fe2O3=2Fe3++3H2O,反应后得到的FeCl3溶液呈棕黄色.用此溶液进行以下实验:(2)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓.
(3)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色色,即可制得Fe(OH)3胶体.
(4)取另一小烧杯也加入20mL蒸馏水后,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处:分别用激光笔照射烧杯中的液体,可以看到乙(答“甲”或“乙”)烧杯中的液体会产生丁达尔效应.
(5)从乙烧杯中取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可看到先沉淀后又溶解的现象,写出沉淀溶解的离子方程式为Fe(OH)3+3H+=Fe3++3H2O.
分析 (1)氧化铁与盐酸反应生成氯化铁和水,
(2)铁离子与NaOH反应生成氢氧化铁沉淀;
(3)铁离子水解生成红褐色氢氧化铁胶体;
(4)胶体具有丁达尔效应,溶液无丁达尔效应;
(5)向Fe(OH)3胶体中滴入稀盐酸,先发生胶体的聚沉,然后二者之间会发生复分解反应;
解答 解:(1)氧化铁与盐酸反应生成氯化铁和水,离子反应为6H++Fe2O3=2Fe3++3H2O,故答案为:6H++Fe2O3=2Fe3++3H2O;
(2)滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子程式为Fe3++3OH-=Fe(OH)3↓,属于复分解反应,故答案为:Fe3++3OH-=Fe(OH)3↓;
(3)加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,液体为胶体分散系,故答案为:红褐;
(4)只有胶体具有丁达尔效应,乙为胶体,故乙能发生丁达尔效应,故答案为:乙;
(5)向Fe(OH)3胶体中滴入稀盐酸,先发生胶体的聚沉,然后二者之间会发生复分解反应,反应的离子方程式:
Fe(OH)3+3H+=Fe3++3H2O;
故答案为:Fe(OH)3+3H+=Fe3++3H2O;
点评 本题是考查了胶体的性质和胶体的制备知识,是对课本知识的考查,较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列图示实验操作中,不正确的是( )
| A. |  滴加液体药品 | B. |  过滤 | C. |  稀释浓硫酸 | D. |  读取液体的体积 |
17.将浓度为0.1mol•L-1Al2(SO4)3溶液加水稀释,下列结论错误的是( )
| A. | 水解平衡正向移动 | B. | 各微粒浓度均变小 | ||
| C. | 溶液中离子数目增多 | D. | c(Al3+)与c(SO42-)的比值减小 |
18.下列反应的离子方程式书写正确的是( )
| A. | Na2O溶于水:Na2O+H2O=2Na++2OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
19.茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )(Fe3+的检验滴加KSCN溶液)
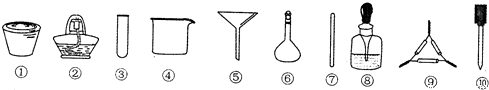

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 检验滤液中的Fe3+,选用③、⑧和⑩ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 过滤得到的滤液,选用④、⑤和⑦ |

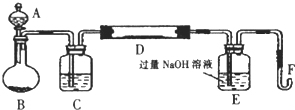
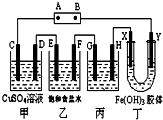 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: