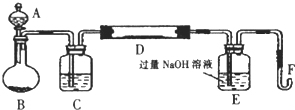
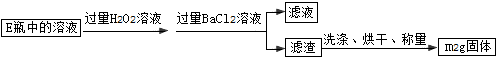
题目内容
13.室温时,M(OH)2(s)═M2+(aq)+2OH-(aq) Ksp=a;c(M2+)=b mol•L-1时,溶液的pH等于( )| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | $\frac{1}{2}$lg($\frac{a}{b}$) | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
分析 先根据该难溶物的溶度积及c(M2+)计算出该溶液中氢氧根离子浓度,然后根据c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$及pH=-lgc(H+)计算出该溶液在常温下pH.
解答 解:Ksp=c(M2+)×c2(OH-)=a,则c(OH-)=$\sqrt{\frac{Ksp}{c({M}^{+})}}$=$\sqrt{\frac{a}{b}}$mol/L,
常温下氢离子浓度为:c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$,
则该溶液的pH=-lgc(H+)=-lg$\frac{1{0}^{-14}}{c(O{H}^{-})}$=
=-lg$\frac{1{0}^{-14}}{\sqrt{\frac{a}{b}}}$=14+$\frac{1}{2}$lg$\frac{a}{b}$.
故选C.
点评 本题考查了难溶物溶度积的计算、溶液pH的计算,题目难度中等,明确溶液pH的表达式及难溶物溶度积的含有即可解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3. 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A. | 物质A、B的转化率之比为a:b | |
| B. | 起始时刻和达平衡后容器中的压强比为(a+b):(a+b-$\frac{n}{2}$) | |
| C. | 若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C | |
| D. | 当v正(A)=2v逆(B)时,可判定反应达到平衡 |
18.下列反应的离子方程式书写正确的是( )
| A. | Na2O溶于水:Na2O+H2O=2Na++2OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
5.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| D. | SO2溶于水能导电,SO2属于电解质 |
2.常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是( )
| A. | c(Ba2+)=c(SO42-) | |
| B. | c(Ba2+)增大,c (SO42-) 减小 | |
| C. | c(Ba2+)≠c SO42-),c(Ba2+)•c(SO42-)=KSP(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠KSP(BaSO4) |
3.从海水中提取金属镁,没有涉及到的化学反应是( )
电解.
电解.
| A. | Mg2++2OH-═Mg(OH)2↓ | B. | Mg(OH)2+2H+═2Mg2++2H2O | ||
| C. | Mg(OH)2═MgO+H2O | D. | MgCl2═Mg+Cl2↑ |
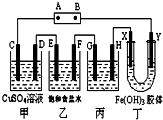 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: