题目内容
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+) | ||
B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
| ||
| C、实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L | ||
| D、实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、酸和碱等浓度等体积混合反应恰好反应生成盐,盐溶液显碱性证明,酸是弱酸,酸根离子水解;
B、根据电荷守恒计算氢氧根离子浓度;
C、依据混合后溶液PH=7 常温下呈中性是弱酸过量,结合溶液中电荷守恒分析;
D、依据混合液显示中性及电荷守恒分析判断.
B、根据电荷守恒计算氢氧根离子浓度;
C、依据混合后溶液PH=7 常温下呈中性是弱酸过量,结合溶液中电荷守恒分析;
D、依据混合液显示中性及电荷守恒分析判断.
解答:
解:A、将0.1mol/L的一元酸HA的溶液和0.1mol/L的KOH溶液等体积混合,恰好反应生成KA盐溶液,溶液pH=9,说明溶液呈碱性,HA为弱酸,A-离子水解,其浓度减小,c(K+)>c(A-),则溶液中离子浓度大小为:c(K+)>c(A-)>c(OH-)>c(H+),故A错误;
B、反应后的溶液中存在电荷守恒:c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)-c(H+)=c(K+)-c(A-)=
mol/Lmol/L-10-9 mol/L,故B错误;
C、混合后溶液pH=7 常温下呈中性是弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L,故C错误;
D、混合后溶液PH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),则:c(K+)=c(A-),所以混合液中一定满足:c(K+)+c(OH-)=c(H+)+c(A-),故D正确;
故选D.
B、反应后的溶液中存在电荷守恒:c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)-c(H+)=c(K+)-c(A-)=
| Kw |
| 1×10-9 |
C、混合后溶液pH=7 常温下呈中性是弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L,故C错误;
D、混合后溶液PH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),则:c(K+)=c(A-),所以混合液中一定满足:c(K+)+c(OH-)=c(H+)+c(A-),故D正确;
故选D.
点评:本题考查酸碱混合的定性判断及溶液中离子浓度大小的比较,题目难度中等,根据电荷守恒、物料守恒及盐的水解原理进行分析解答即可,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
根据部分短周期元素的原子半径及主要化合价信息,下列判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |
室温下,若溶液中由水电离产生c(OH-)=1×10-14 mol?L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、AlO2- |
| C、K+、Na+、Cl-、NO3- |
| D、K+、NH4+、SO42-、NO3- |
以下各分子中,所有原子都满足最外层为8电子结构的是( )
| A、H3O+ |
| B、BF3 |
| C、P4 |
| D、PCl5 |
下列电离方程式的书写正确的是( )
| A、Na2CO3=2Na++CO32- |
| B、CuCl2=Cu+Cl2↑ |
| C、NaHCO3=Na++H++CO32- |
| D、Ba(OH)2=Ba+2OH- |
下列对分子的结构和性质的说法中,错误的是( )
| A、同碳原子数的醇分子中羟基数目越多,该物质就越易溶于水 |
B、乳酸 ( )分子中含有手性碳原子 )分子中含有手性碳原子 |
| C、白磷分子和甲烷分子均为正四面体,键角为109°28′ |
| D、H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
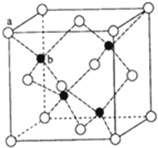 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.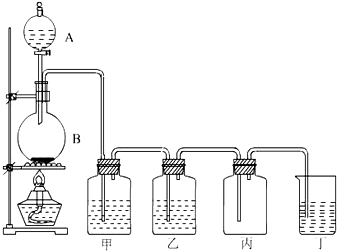 实验室制氯气的实验装置图如下所示:
实验室制氯气的实验装置图如下所示: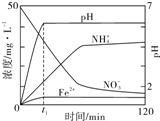 某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.
某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.