题目内容
①N原子的摩尔质量是 ,1.5mol HNO3约含有 个氢原子.含0.6mol H 的C6H12O6的物质的量是 mol.
②22克CO2的物质的量为 mol,该气体在标准状况下的体积为 L.
②22克CO2的物质的量为
考点:摩尔质量,物质的量的相关计算
专题:计算题
分析:根据n=
=
=
计算相关物理量,然后填空即可.
| m |
| M |
| N |
| NA |
| V |
| Vm |
解答:
解:①M(N)=14g/mol,1.5molHNO3含有1.5molH原子,N(H)=1.5NA,含0.6molH的C6H12O6的物质的量是
=0.05mol,
故答案为:14g/mol;1.5NA;0.05;
②n(CO2)=
=0.5mol,该气体在标准状况下的体积为0.5mol×22.4L/mol=11.2L,
故答案为:0.5;11.2.
| 0.6mol |
| 12 |
故答案为:14g/mol;1.5NA;0.05;
②n(CO2)=
| 22g |
| 44g/mol |
故答案为:0.5;11.2.
点评:本题逐一考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及物质的构成,难度不大.

练习册系列答案
相关题目
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的热稳定性c>d,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |
能在水溶液中大量共存的一组离子是( )
| A、K+、H+、NO3-、SiO32- |
| B、H+、NH4+、Al3+、SO42- |
| C、Fe2+、H+、ClO-、SO42- |
| D、Al3+、Mg2+、SO42-、CO32- |
以下各分子中,所有原子都满足最外层为8电子结构的是( )
| A、H3O+ |
| B、BF3 |
| C、P4 |
| D、PCl5 |
通过复习总结,你认为下列对化学知识概括合理的是( )
| A、金属氧化物都是强电解质 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 |
| D、能与金属镁反应产生氢气的溶液一定是酸溶液 |
下列说法正确的是( )
| A、已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | ||||||||||
| B、已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有:c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 mol2/L2 | ||||||||||
| C、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因可能是NH4+结合OH-使沉淀溶解平衡发生移动 | ||||||||||
D、已知:
 (g)+3H2(g)→ (g)+3H2(g)→ (g) 的焓变 (g) 的焓变 |
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):下列说法不正确的是( )


| A、混合物中不存在FeCl2 |
| B、反应④的离子反应式 AlO2-+H++H2O═Al(OH)3↓ |
| C、混合物一定含有Al、(NH4)2SO4和MgCl2三种物质,无法判断混合物中是否含有AlCl3 |
| D、白色沉淀5.80g 是Mg(OH)2 |
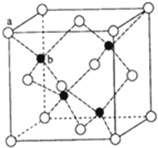 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.