题目内容
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、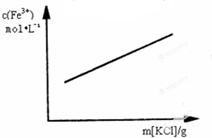 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、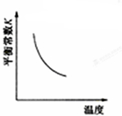 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
考点:化学平衡的影响因素
专题:图示题,化学平衡专题
分析:A、FeCl3+3KSCN?Fe(SCN)3+KCl,离子方程式为Fe3++3SCN-=Fe(SCN)3,KCl对平衡无影响;
B、2NO+O2?2NO2△H<0,反应是放热反应,升温平衡逆向进行;
C、反应是放热反应,升温平衡逆向进行,平衡常数减小;
D、根据“定一议二”分析,反应是放热反应,温度升高平衡逆向进行;
B、2NO+O2?2NO2△H<0,反应是放热反应,升温平衡逆向进行;
C、反应是放热反应,升温平衡逆向进行,平衡常数减小;
D、根据“定一议二”分析,反应是放热反应,温度升高平衡逆向进行;
解答:
解:A、FeCl3+3KSCN?Fe(SCN)3+KCl,离子方程式为Fe3++3SCN-=Fe(SCN)3,KCl对平衡无影响,加入氯化钾忽略液体体积变化,铁离子浓度不变,故A错误;
B、2NO+O2?2NO2△H<0,反应是放热反应,升温平衡逆向进行,一氧化氮转化率减小,B点为正向进行,正反应速率大于逆反应速率,故B错误;
C、反应是放热反应,升温平衡逆向进行,平衡常数减小,图象符合,故C正确;
D、根据“定一议二”分析,反应是放热反应,温度升高平衡逆向进行,AB3含量减小,增大压强平衡正向进行,AB3含量增大,图象符合,故D正确;
故选CD.
B、2NO+O2?2NO2△H<0,反应是放热反应,升温平衡逆向进行,一氧化氮转化率减小,B点为正向进行,正反应速率大于逆反应速率,故B错误;
C、反应是放热反应,升温平衡逆向进行,平衡常数减小,图象符合,故C正确;
D、根据“定一议二”分析,反应是放热反应,温度升高平衡逆向进行,AB3含量减小,增大压强平衡正向进行,AB3含量增大,图象符合,故D正确;
故选CD.
点评:本题考查了化学平衡影响因素分析判断,图象分析方法,平衡移动原理是解题关键,题目较简单.

练习册系列答案
相关题目
酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( )
①乙醇密度比水小 ②乙醇沸点低 ③乙醇有还原性④乙醇是烃的含氧衍生物.
①乙醇密度比水小 ②乙醇沸点低 ③乙醇有还原性④乙醇是烃的含氧衍生物.
| A、②④ | B、②③ | C、①④ | D、①③ |
已知水和苯互不相溶,苯不与钠反应,在烧杯中加水和苯(密度:0.88g/cm3)各50mL.将一小粒金属钠(密度:0.97g/cm3)投入烧杯中,观察到的现象可能是( )
| A、钠在水层中反应并四处游动 |
| B、钠停留在苯层中不发生反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能做上、下跳动 |
下列过程中△H小于零的是( )
| A、氯酸钾分解制氧气 |
| B、氯化铵受热分解 |
| C、氢气还原氧化铜 |
| D、实验室用锌和稀硫酸反应制氢气 |
常温下,PH=3的HCl和PH=11的NH3?H2O等体积混合反应后,溶液中各离子浓度大小比较是( )
| A、C(Cl-)>C(NH4+)>C(H+)>C(OH-) |
| B、C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| C、C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| D、C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A、原子化热:Y>Z |
| B、WX3和水反应形成的化合物是离子化合物 |
| C、气态氢化物的热稳定性:R<W |
| D、Y和Z两者最高价氧化物的晶格能Z>Y |
在①小苏打、②纯碱、③氧化铝、④丙氨酸、⑤硫化铵五种化合物中,既能与盐酸反应,又能与氢氧化钠反应的是( )
| A、③④ | B、③④⑤ |
| C、①②③④ | D、①③④⑤ |
关于晶体的下列说法正确的是( )
| A、化学键都具有饱和性和方向性 |
| B、晶体中只要有阴离子,就一定有阳离子 |
| C、氢键具有方向性和饱和性,也属于一种化学键 |
| D、金属键由于无法描述其键长、键角,故不属于化学键 |