题目内容
已知水和苯互不相溶,苯不与钠反应,在烧杯中加水和苯(密度:0.88g/cm3)各50mL.将一小粒金属钠(密度:0.97g/cm3)投入烧杯中,观察到的现象可能是( )
| A、钠在水层中反应并四处游动 |
| B、钠停留在苯层中不发生反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能做上、下跳动 |
考点:钠的化学性质
专题:金属概论与碱元素
分析:Na和水发生反应2Na+2H2O=2NaOH+H2↑,密度:H2O>Na>苯,Na和苯不反应,苯和水不互溶,会分层且水在下层,据此分析解答.
解答:
解:密度:H2O>Na>苯,苯和水不互溶,所以水和苯分层,且水在下层,钠和苯不反应,钠能与水反应产生气体,在与水反应生成气体后被气体带离水层,进入苯层后停止反应又下沉,如此往复,直至钠反应完,故选D.
点评:本题考查了钠的性质,同时考查学生分析问题能力,知道苯和水的是否互溶、钠和水的反应特点即可解答,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
联氨被亚硝酸氧化可生成HN3,化学方程式为N2H4+HNO2═HN3+2H2O.下列说法正确的是( )
| A、HN3只是氧化产物,且分子中存在极性键和非极性键 |
| B、联氨常温下为液态,是因为N2H4分子间存在氢键 |
| C、每生成2mol H2O,反应中转移电子的物质的量一定为4mol |
| D、联氨(N2H4)分子中σ键和π键个数比为2:1 |
下列有关化学用语表示正确的是( )
A、N2的电子式: |
| B、氯化钠的分子式:NaCl |
C、S2-的结构示意图: |
| D、乙烯的结构简式:C2H4 |
一定温度下,在某2L恒容密闭容器中加入纳米级Cu2O并通入0.1mol H2O(g),发生反应:2H2O(g)
2H2(g)+O2(g)△H=+484kJ?mol-1,不同时间产生O2的物质的量见下表
下列说法不正确的是( )
| Co2O |
| 光照 |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
| A、达到平衡时,需要从外界吸收的能量为0.968kJ |
| B、前20min内的平均反应速率v(H2O)=2.5×10-5mol?L-1?min-1 |
| C、增大c(H2O),可以提高水的分解速率 |
| D、使用颗粒更小的纳米级Cu2O,可以增大反应速率 |
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成.则下列分子中的σ键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是( )
| A、H2 |
| B、HCl |
| C、Cl2 |
| D、F2 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、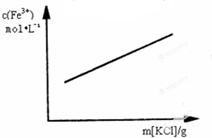 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、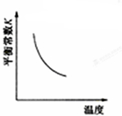 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
下列有关化学键的叙述,正确的是( )
| A、离子化合物中一定含有离子键 |
| B、单质分子中均存在化学键 |
| C、由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
| D、含有共价键的化合物一定是共价化合物 |
下列说法正确的是( )
| A、原子的电子层数越多,原子半径越大 |
| B、同族元素相差的原子序数可能为16、26、36、46 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、卤族元素的单质均有氧化性,最高正价都是+7 |