题目内容
判断下列分子的极性(极性分子或非极性分子)及分子空间构型(直线形或平面三角形或三角锥形或正四面体形)
①CH4: ②CO2: ③P4: ④H2O: .
①CH4:
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:P4为正四面体构型,根据价层电子对互斥理论确定其它分子空间构型;
由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答:
解:①CH4中C原子没有孤对电子,价层电子对数为4,为正四面体结构,正负电荷的中心重合,属于非极性分子,故答案为:非极性分子,正四面体;
②CO2分子中C原子孤电子对数=
=0、价层电子对数=2+0=2,故为直线型,正负电荷的中心重合,属于非极性分子,故答案为:非极性分子,直线型;
③P4属于正四面体结构,由结构对称,由非极性键构成,属于非极性分子,故答案为:非极性分子,正四面体;
④H2O分子中O原子孤电子对数=
=2、价层电子对数=2+2=4,故为V型,正负电荷的中心不重合,属于极性分子,故答案为:极性分子,V型.
②CO2分子中C原子孤电子对数=
| 4-2×2 |
| 2 |
③P4属于正四面体结构,由结构对称,由非极性键构成,属于非极性分子,故答案为:非极性分子,正四面体;
④H2O分子中O原子孤电子对数=
| 6-1×2 |
| 2 |
点评:本题考查分子极性与空间结构的判断,难度不大,注意根据价层电子对互斥理论或杂化理论判断分子空间构型.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列粒子的个数之比不是1:1的是( )
| A、氘原子中的质子和中子 |
| B、C2H4分子中的质子和电子 |
| C、Na2O2固体中的阴离子和阳离子 |
| D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
联氨被亚硝酸氧化可生成HN3,化学方程式为N2H4+HNO2═HN3+2H2O.下列说法正确的是( )
| A、HN3只是氧化产物,且分子中存在极性键和非极性键 |
| B、联氨常温下为液态,是因为N2H4分子间存在氢键 |
| C、每生成2mol H2O,反应中转移电子的物质的量一定为4mol |
| D、联氨(N2H4)分子中σ键和π键个数比为2:1 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、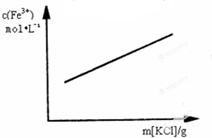 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、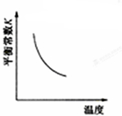 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
 氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素.
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素.