题目内容
常温下,PH=3的HCl和PH=11的NH3?H2O等体积混合反应后,溶液中各离子浓度大小比较是( )
| A、C(Cl-)>C(NH4+)>C(H+)>C(OH-) |
| B、C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| C、C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| D、C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:常温下,PH=3的HCl和PH=11的NH3?H2O溶液,c(HCl)<c(NH3?H2O),二者等体积混合,氨水有剩余,溶液呈碱性,再结合电荷守恒判断离子浓度大小.
解答:
解:常温下,PH=3的HCl和PH=11的NH3?H2O溶液,c(HCl)<c(NH3?H2O),二者等体积混合,氨水有剩余,一水合氨电离程度大于铵根离子水解程度,所以溶液呈碱性,则C(OH-)>C(H+),根据电荷守恒得,再结合电荷守恒C(OH-)+C(Cl-)=C(NH4+)+C(H+),所以C(NH4+)>C(Cl-),溶液中一水合氨电离程度较小,所以溶液中离子浓度大小顺序是C(NH4+)>C(Cl-)>C(OH-)>C(H+),故选C.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及其性质再结合电荷守恒解答即可,注意:氨水溶液中一水合氨电离程度很小.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
A、N2的电子式: |
| B、氯化钠的分子式:NaCl |
C、S2-的结构示意图: |
| D、乙烯的结构简式:C2H4 |
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成.则下列分子中的σ键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是( )
| A、H2 |
| B、HCl |
| C、Cl2 |
| D、F2 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、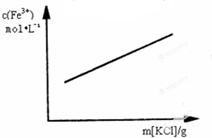 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、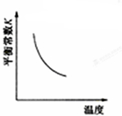 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
下列有关化学键的叙述,正确的是( )
| A、离子化合物中一定含有离子键 |
| B、单质分子中均存在化学键 |
| C、由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
| D、含有共价键的化合物一定是共价化合物 |
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
| A、2NaBr+Cl2═2NaCl+Br2 |
| B、2H2S+SO2═2H2O+3S↓ |
| C、2Fe+3Cl2=2FeCl3 |
| D、AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl |
下列说法正确的是( )
| A、将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3 | ||
| B、在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变 | ||
C、0.1 mol/L CH3COOH溶液在稀释过程中
| ||
| D、已知MgCO3的Ksp═6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)═c(CO32-),且c(Mg2+)?c(CO32-)═6.82×10-6 |