题目内容
在①小苏打、②纯碱、③氧化铝、④丙氨酸、⑤硫化铵五种化合物中,既能与盐酸反应,又能与氢氧化钠反应的是( )
| A、③④ | B、③④⑤ |
| C、①②③④ | D、①③④⑤ |
考点:镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:既能与盐酸反应又能与氢氧化钠溶液反应的物质有:两性化合物(如Al2O3、Al(OH)3等)、弱酸的铵盐(如(NH4)2CO3等)、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸、蛋白质等.
解答:
解:小苏打为NaHCO3,是弱酸的酸式盐,与盐酸反应生成氯化钠、水和二氧化碳,与氢氧化钠溶液反应可以生成碳酸钠与水;
纯碱为Na2CO3,与盐酸反应生成氯化钠、水和二氧化碳,与氢氧化钠溶液不反应;
氧化铝是两性氧化物,与盐酸反应生成氯化铝与水,与氢氧化钠溶液反应生成偏铝酸钠与水;
丙氨酸属于氨基酸,既能与盐酸反应,又能和氢氧化钠溶液反应;
硫化铵属于弱酸的铵盐,和盐酸反应生成氯化铵和硫化氢,与氢氧化钠反应生成硫化钠和一水合氨(加热放出氯气),
综上所述:既能与盐酸反应,又能与氢氧化钠反应的是①③④⑤;
故选:D.
纯碱为Na2CO3,与盐酸反应生成氯化钠、水和二氧化碳,与氢氧化钠溶液不反应;
氧化铝是两性氧化物,与盐酸反应生成氯化铝与水,与氢氧化钠溶液反应生成偏铝酸钠与水;
丙氨酸属于氨基酸,既能与盐酸反应,又能和氢氧化钠溶液反应;
硫化铵属于弱酸的铵盐,和盐酸反应生成氯化铵和硫化氢,与氢氧化钠反应生成硫化钠和一水合氨(加热放出氯气),
综上所述:既能与盐酸反应,又能与氢氧化钠反应的是①③④⑤;
故选:D.
点评:本题考查了元素化合物的性质,难度不大,明确物质的性质是解本题的关键,注意归纳中学常见的既能与酸反应又能与碱反应的物质.

练习册系列答案
相关题目
联氨被亚硝酸氧化可生成HN3,化学方程式为N2H4+HNO2═HN3+2H2O.下列说法正确的是( )
| A、HN3只是氧化产物,且分子中存在极性键和非极性键 |
| B、联氨常温下为液态,是因为N2H4分子间存在氢键 |
| C、每生成2mol H2O,反应中转移电子的物质的量一定为4mol |
| D、联氨(N2H4)分子中σ键和π键个数比为2:1 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、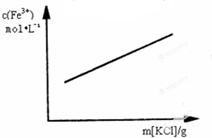 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、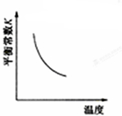 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
下列有关化学键的叙述,正确的是( )
| A、离子化合物中一定含有离子键 |
| B、单质分子中均存在化学键 |
| C、由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
| D、含有共价键的化合物一定是共价化合物 |
如图表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )


| A、通常情况下五种元素的单质中,Z单质的沸点最高 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物的沸点比X的氢化物的沸点高 |
| D、第一电离能:R>W>Y |
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
| A、2NaBr+Cl2═2NaCl+Br2 |
| B、2H2S+SO2═2H2O+3S↓ |
| C、2Fe+3Cl2=2FeCl3 |
| D、AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl |
在可逆反应:X(g)+2Y(g)?2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是( )
| A、高温高压 | B、高温低压 |
| C、低温高压 | D、低温低压 |
下列说法正确的是( )
| A、原子的电子层数越多,原子半径越大 |
| B、同族元素相差的原子序数可能为16、26、36、46 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、卤族元素的单质均有氧化性,最高正价都是+7 |
下列分子中,电子总数最少的是( )
| A、H2S |
| B、O2 |
| C、CO |
| D、NO |