题目内容
下列过程中△H小于零的是( )
| A、氯酸钾分解制氧气 |
| B、氯化铵受热分解 |
| C、氢气还原氧化铜 |
| D、实验室用锌和稀硫酸反应制氢气 |
考点:吸热反应和放热反应
专题:化学反应中的能量变化
分析:△H小于零,应是放热反应,常见有化合反应,金属与酸、水的反应,以及中和反应等,以此解答该题.
解答:
解:A.氯酸钾分解制氧气为吸热反应,△H>0,故A错误;
B.氯化铵加热制备氨气为分解反应,需要吸热,△H>0,故B错误;
C.氢气还原氧化铜为吸热反应,△H>0,故C错误;
D.实验室制备氢气用锌和稀硫反应,为放热反应,△H<0,故D正确.
故选D.
B.氯化铵加热制备氨气为分解反应,需要吸热,△H>0,故B错误;
C.氢气还原氧化铜为吸热反应,△H>0,故C错误;
D.实验室制备氢气用锌和稀硫反应,为放热反应,△H<0,故D正确.
故选D.
点评:本题考查反应热与焓变,题目难度不大,注意常见吸热反应和放热反应即可解答该题,学习中注意相关基础知识的积累.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
以下用于除去乙酸乙酯中乙酸和乙醇杂质的最好试剂是( )
| A、饱和碳酸钠溶液 | B、氢氧化钠溶液 |
| C、苯 | D、水 |
一定温度下,在某2L恒容密闭容器中加入纳米级Cu2O并通入0.1mol H2O(g),发生反应:2H2O(g)
2H2(g)+O2(g)△H=+484kJ?mol-1,不同时间产生O2的物质的量见下表
下列说法不正确的是( )
| Co2O |
| 光照 |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
| A、达到平衡时,需要从外界吸收的能量为0.968kJ |
| B、前20min内的平均反应速率v(H2O)=2.5×10-5mol?L-1?min-1 |
| C、增大c(H2O),可以提高水的分解速率 |
| D、使用颗粒更小的纳米级Cu2O,可以增大反应速率 |
下列物质存在顺反异构的是( )
| A、1-丁烯 |
| B、2-氯丙烯 |
| C、2-甲基-2-丁烯 |
| D、2─丁烯 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、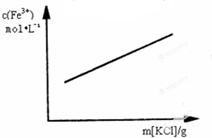 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、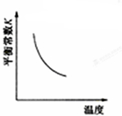 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
对下列金属采取的防护方法中,属于电化学防护的是( )
| A、在金属表面刷油漆 |
| B、在金属表面进行电镀 |
| C、将铁阀门与直流电源的负极相连 |
| D、在一定条件下对金属进行处理,在其表面形成一层致密的氧化膜 |
如图表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )


| A、通常情况下五种元素的单质中,Z单质的沸点最高 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物的沸点比X的氢化物的沸点高 |
| D、第一电离能:R>W>Y |
下列化学(或离子)方程式正确的是( )
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |||
B、C6H6+HNO3
| |||
| C、亚硫酸的电离方程式:H2SO3?2H++SO32- | |||
| D、醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O |