题目内容
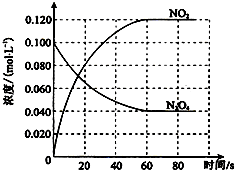 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol?L-1?s-1的平均速率降低,经10s又达到平衡.
①T
②列式计算温度T时反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据反应速率v=
计算;化学平衡常数利用化学平衡常数表达式计算;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
| △c |
| △t |
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
解答:
解:(1)0~60s时段,N2O4浓度变化为:0.100mol/L-0.040mol/L=0.060mol/L,v(N2O4)=0.060mol/L
=0.0010mol?L-1?s-1;
K=
=
=0.36mol/L,
故答案为:0.0010;0.36mol/L;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;反应正方向吸热,反应向吸热方向进行,故温度升高;
②平衡时,c(NO2)=0.120mol?L-1+0.0020mol?L-1?s-1×10s×2=0.16mol?L-1,c(N2O4)=0.040mol?L-1-0.0020mol?L-1?s-1×10s=0.020mol?L-1,K2=
=1.3mol/L,故答案为:=1.3mol/L;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆反应;对气体分子数增大的反应,增大压强平衡向逆方向移动.
| 0.060mol/L |
| 60S |
K=
| c2(NO2) |
| c(N2O4) |
| (0.120mol/L)2 |
| 0.040mol/L |
故答案为:0.0010;0.36mol/L;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;反应正方向吸热,反应向吸热方向进行,故温度升高;
②平衡时,c(NO2)=0.120mol?L-1+0.0020mol?L-1?s-1×10s×2=0.16mol?L-1,c(N2O4)=0.040mol?L-1-0.0020mol?L-1?s-1×10s=0.020mol?L-1,K2=
| (0.16mol/L)2 |
| 0.020mol/L |
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆反应;对气体分子数增大的反应,增大压强平衡向逆方向移动.
点评:本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,注意根据图象判断平衡时刻,根据平衡时的浓度计算平衡常数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
若将某种富含维生素C的水果切碎捣烂,加水溶解,提取其滤液就能达到充分提取水果中的维生素c的目的,这说明服用维生素c可使食物中的Fe3+转化成Fe2+,有利于人体吸收,在该化学反应中维生素c体现( )
| A、能溶于水,氧化性 |
| B、不能溶于水,氧化性 |
| C、能溶于水,还原性 |
| D、不能溶于水,还原性 |
下列图象表达正确的是( )

| A、浓硫酸的稀释 |
| B、过量的盐酸与等量的锌粉反应 |
| C、氢气与氧气反应中的能量变化 |
| D、微粒电子数 |
将标准状况下密度为ρg/L的HCl气体V L溶于1000g水中,得到密度为b g/cm3的盐酸,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
将钠投入到滴有酚酞的水中,下列有关叙述中不正确的是( )
| A、产生无色气体 |
| B、Na下沉 |
| C、溶液变红 |
| D、Na块熔化成小球 |
某有机物的氧化产物是甲,还原产物是乙.甲和乙都能与钠反应放出H2,甲和乙反应生成丙,甲和丙都能发生银镜反应.该有机物是( )
| A、甲醛 | B、乙醛 | C、甲酸 | D、甲醇 |