题目内容
2.按要求完成下列填空:(1)0.36g水的物质的量为0.02mol;所含氢原子数为0.04NA.
(2)在标准状况下,2.2g CO2的体积是1.12L;
(3)2mol SO3和3mol SO2其分子数之比为2:3;相同状况下(均为气体)体积之比为2:3;氧原子数之比为1:1.
(4)将21.2g Na2CO3溶于水配成500mL 溶液,所得溶液的物质的量浓度是0.4mol/L;
(5)写出NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO3-;
(6)写出碳酸钙与盐酸溶液反应的离子方程式:CaCO3+2H+═Ca2++H2O+CO2↑.
分析 (1)根据公式n=$\frac{m}{M}$结合物质的原子构成来计算;
(2)根据公式V=nVm来计算;
(3)根据N=nNASO3和3mol SO2其分子数之比等于物质的量之比,根据公式V=nVm,相同状况下(均为气体)体积之比等于物质的量之比,结合物质的原子构成来计算;
(4)根据c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$来计算;
(5)NaHCO3在水溶液中的电离出钠离子和碳酸根离子;
(6)碳酸钙与盐酸溶液反应生成氯化钙、水以及二氧化碳.
解答 解:(1)0.36g水的物质的量为$\frac{0.36g}{18g/mol}$=0.02mol;所含氢原子是0.04mol,个数为0.04NA,故答案为:0.04NA;
(2)在标准状况下,2.2g CO2的体积是V=nVm=$\frac{m}{M}$Vm=$\frac{2.2g}{44g/mol}×22.4L/mol$=1.12L,故答案为:1.12L;
(3)根据N=nNA知,物质的量相等时其分子数相等,2mol SO3和3mol SO2其分子数之比为2:3,同状况下(均为气体)体积之比为等于物质的量之比是2:3,每个二氧化硫、三氧化硫分子中分别含有2个、3个O原子,所以O原子总数之比为1:1,故答案为:2:3;2:3;1:1;
(4)21.2g Na2CO3溶于水配成500mL 溶液,所得溶液的物质的量浓度是c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{\frac{21.2g}{106g/mol}}{0.5L}$=0.4mol/L,故答案为:0.4mol/L;
(5)NaHCO3在水溶液中的电离出钠离子和碳酸根离子,电离方程式为:NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-;
(6)碳酸钙与盐酸溶液反应生成氯化钙、水以及二氧化碳,反应为:CaCO3+2H+═Ca2++H2O+CO2↑,故答案为:CaCO3+2H+═Ca2++H2O+CO2↑.
点评 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,注意气体摩尔体积的适用范围及适用条件,题目难度不大.

| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
| A. | ①⑤ | B. | ②④ | C. | ①②④ | D. | ②③④ |

| A. | 铜作负极 | B. | 锌作正极 | ||
| C. | 电子由铜经导线流向锌 | D. | 锌片上的反应为:Zn-2e-=Zn2+ |
| A. | AgCl | B. | 硝酸钾溶液 | C. | NH3 | D. | 二氧化碳 |
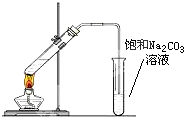 实验室可以用图所示的装置制取乙酸乙酯.回答下列问题:
实验室可以用图所示的装置制取乙酸乙酯.回答下列问题: