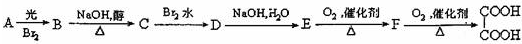题目内容
1.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
分析 A.反应后溶质为等浓度的醋酸和氯化钠,醋酸为弱酸,部分电离出醋酸根离子和氢离子,氢离子还来自水的电离,则c(H+)>c(CH3COO-);
B.混合液的pH大于7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可知c(NH4+)>c(Cl-)>c(NH3•H2O);
C.根据混合液中的物料守恒判断;
D.根据混合液中的电荷守恒判断.
解答 解:A.0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合生成等浓度的NaCl和CH3COOH,由于醋酸部分电离出氢离子和醋酸根离子,而氢离子还来自水的电离,则c(H+)>c(CH3COO-),正确的离子浓度大小为:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-),故A错误;
B.0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合,溶液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可知c(NH4+)>c(Cl-)>c(NH3•H2O),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故B错误;
C.0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合,根据物料守恒可得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),即:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C正确;
D.0.1mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸),反应生成NaHC2O4,根据电荷守恒可得:2c(C2O42-)+c(HC2O4-)+c(Cl-)+c(OH-)=c(Na+)+c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及在离子浓度大小比较中的应用方法,试题培养了学生的灵活应用能力.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是防止Fe2+水解.
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是冷却结晶,洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(4)“沉淀2”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是
用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净
(5)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤
【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,使C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉,加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
| A. | 2.3g | B. | 3.2g | C. | 4.6g | D. | 不可求 |
| A. | 石油裂解只破坏极性键 | |
| B. | 含极性键的共价化合物一定是电解质 | |
| C. | 氯化钠固体中的离子键在溶于水时被破坏 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl稳定 |
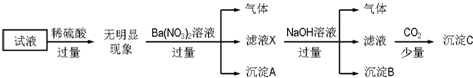
下列说法正确的是( )
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |