题目内容
3.由Zn-Cu-H2SO4组成的原电池,工作一段时间后,锌片质量减少了13.0g.求:(1)原电池生成氢气4.48L(标准状况).
(2)已知1mol氢气完全燃烧放出285.8kJ的热量.将(1)中获得的氢气燃烧,可以得到57.16kJ的热量.
(3)若起始时刻两电极质量相等,将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为25.8g.
分析 该原电池反应式为Zn+H2SO4=ZnSO4+H2↑,
(1)根据锌和氢气之间的关系式计算生成氢气体积;
(2)根据氢气和反应热之间的关系式计算;
(3)根据转移电子相等计算析出铜的质量,两极质量差等于溶解锌的质量与析出铜质量之和.
解答 解:(1)Zn-Cu-H2SO4组成的原电池电池反应为:Zn+H2SO4=ZnSO4+H2↑,根据方程式知,参加反应的n(Zn)=n(H2)=$\frac{13.0g}{65g/mol}$=0.2mol,标准状况下V(H2)=0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(2)根据题意知,1mol氢气完全燃烧放出285.8kJ的热量,则0.2mol氢气完全燃烧放出的热量为:285.8kJ/mol×0.2mol=57.16kJ,
故答案为:57.16;
(3)当电解质溶液改为硫酸铜溶液时,电池反应为:Zn+CuSO4=ZnSO4+Cu,参加反应的n(Zn)与生成铜的物质的量相等,则n(Zn)=n(Cu)=$\frac{13.0g}{65g/mol}$=0.2mol,析出m(Cu)=0.2mol×64g/mol=12.8g,两个电极的差为减少的锌的质量与析出铜质量的和,两个电极的质量差=13.0g+12.8g=25.8g,
故答案为:25.8.
点评 本题考查原电池原理,题目难度中等,明确方程式中各个物理量之间的关系式即可解答,易错点是(3),注意两个电极质量差为溶解锌的质量和析出铜质量的和,不是溶解锌的质量与析出铜质量的差.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
9.制备纯净的液态无水四氯化锡(SnCl4)易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4Sn也可以与HCl反应生成SnCl2已知:
某同学设计的相关实验装置图如图所示
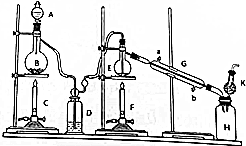
(1)A中浓盐酸与B中物质进行反应化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O
(2)D中的试剂为浓硫酸目的是干燥氯气,防止生成的四氯化锡发生水解反应
(3)G中冷却水的进水位置为b(填字母)
| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |

(1)A中浓盐酸与B中物质进行反应化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O
(2)D中的试剂为浓硫酸目的是干燥氯气,防止生成的四氯化锡发生水解反应
(3)G中冷却水的进水位置为b(填字母)
18.对于原电池的电极名称叙述有错误的是( )
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 电流的方向由正极到负极 |
15.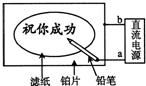 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
13.人工肾脏可用间接电化学方法除去代谢产物中的尿素[分子式为CO(NH2)2],原理如图所示.下列有关说法中错误的是( )

| A. | 电解结束后,阴极室溶液的pH与电解前相比将变大 | |
| B. | 若用铅蓄电池作该装置的供电电源,B接线柱应连接Pb | |
| C. | 涉及除去尿素的反应为CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl | |
| D. | 若通电一段时间后,电路中通过的电量是77.06×104C,则有8NA个H+通过质子交换膜 (一个电子所带的电量为1.6×10-19C) |
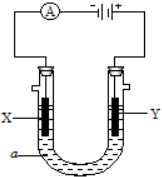 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
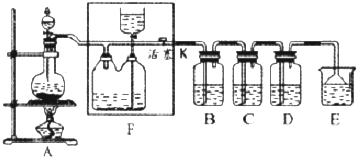
 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.