题目内容
12. 请回答下列问题:
请回答下列问题:(1)已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1.N2(g)+O2(g)=2NO(g)△H=+180.0kJ•mol-1.则相同条件下破坏NO分子中化学键需要吸收的能量为631.5kJ.
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=1.0×10-9 kJ•mol-1;往溶液中加入少量NaOH固体,则溶液中$\frac{c(CH_3COOH)}{[c(CH_3COO^-)•c(H^+)]}$不变(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:c(CH3COO-)+c(OH-)=c(Na+)+c(H+).
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示.
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存.
②当pH=7时,溶液中含碳元素的微粒主要为HCO3-、H2CO3.溶液中各种离子的物质的量浓度大小关系为c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+).
③反应的CO32-+H2O═HCO3-+OH-的平衡常数Kh=10-4.
分析 (1)旧键断裂吸收的能量减去新键生成释放的能量值即为化学反应所吸收的能量,结合N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,N2(g)+O2(g)=2NO(g),△H=+180kJ•mol-1可以计算NO分子中化学键的键能;
(2)溶液中pH=-lgc(H+),CH3COOH为酸,水电离出的c(H+)等于溶液中c(OH-);往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})c({H}^{+})}$=$\frac{1}{Ka}$温度不变电离平衡常数不变,溶液中存在电荷守恒;
(3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①根据图2可知,pH=8时只有碳酸氢根离子,pH大于8时存在碳酸根离子和碳酸氢根离子离子,pH小于8时存在碳酸和碳酸氢根离子,在同一溶液中,H2CO3、HCO3-、CO32-不能共存;
②pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,存在的离子主要为:H2CO3、HCO3-,溶液显示中性,c(H+)=c(OH-),根据电荷守恒判断溶液中各离子浓度大小关系;
③当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知PH=10,c(H+)=10-10mol/L,由Kw可知c(OH-)=10-4mol/L,据此计算水解平衡常数.
解答 解:(1)根据N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1可设NO分子中化学键的键能为X,则有:946kJ•mol-1+497kJ•mol-1-2X=180kJ•mol-1 得:X=631.5kJ•mol-1,
故答案为:631.5;
(2)CH3COOH为酸,pH=-lgc(H+),pH等于5的CH3COOH溶液中C(H+)=1.0×10-5mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})c({H}^{+})}$=$\frac{1}{Ka}$温度不变电离平衡常数不变,溶液中存在电荷守恒,离子浓度关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),
故答案为:1.0×10-9mol/L;不变;c(CH3COO-)+c(OH-)=c(Na+)+c(H+);
(3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,
故答案为:不能;
②由图象可知,pH=7时,c(OH-)=c(H+),溶液中含碳元素的主要微粒为HCO3-、H2CO3,电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),则c(Na+)>c(Cl-),因HCO3-水解,则c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+),
故答案为:HCO3-、H2CO3;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+);
③CO32-的水解常数Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知PH=10,c(H+)=10-10mol/L,由Kw可知c(OH-)=10-4mol/L,
则Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=c(OH-)=10-4mol/L,
故答案为:10-4.
点评 本题考查较综合,涉及热化学方程式书写、盐类的水解、平衡常数计算、弱电解质的电离及溶液中酸碱之间的反应,题目难度中等,综合考查学生分析问题、解决问题的能力,注重能力的考查.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | B. | c(K+)+c(S2-)=0.3mol/L | ||
| C. | c(K+)=2[c(S2-)+c(HS-)+c(H2S)] | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
| A. | 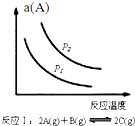 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=-2Q1kJ/mol | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为 N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 kJ•mol-1 | |
| D. | 已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)?H2O(l) △H=-57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=-114.6kJ/mol |
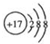 .
.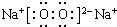 ,该产物所含有的化学键类型有离子键、非极性键.
,该产物所含有的化学键类型有离子键、非极性键.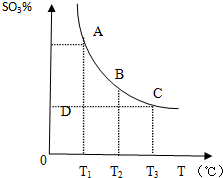 运用化学原理研究元素及其化合物的反应有重要意义.
运用化学原理研究元素及其化合物的反应有重要意义.
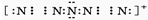 .
.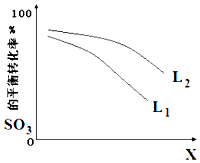 高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成: