题目内容
2.下列热化学方程式正确的是( )| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=-2Q1kJ/mol | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为 N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 kJ•mol-1 | |
| D. | 已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)?H2O(l) △H=-57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=-114.6kJ/mol |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,生成的水应该为液态水;
B.生成气态水时放出的热量偏小,则2mol液态水分解吸收的热量大于2Q1kJ,且水分解的焓变应该大于0;
C.根据n=$\frac{m}{M}$计算出1g肼的物质的量,然后可计算出1mol肼完全燃烧放出的热量,再根据热化学方程式的书写原则分析;
D.中和热是强酸强碱稀溶液生成1mol水放出的热量,氢氧化钡和硫酸中和反应生成水和沉淀,沉淀过程含有沉淀热.
解答 解:A.甲烷燃烧热是1mol甲烷完全燃烧生成稳定氧化物放出的热量,热化学方程式中水是气体,正确的热化学方程式为:甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.已知H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-Q1kJ/mol,若生成1mol液态水时放出的热量会大于Q1kJ,则2H2O(l)=2H2(g)+O2(g)△H>2Q1kJ/mol,故B错误;
C.1 g液态肼的物质的量为:$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,则1mol液态肼完全反应放出的热量为:20.05 kJ×$\frac{1mol}{\frac{1}{32}mol}$=641.6kJ,该反应的化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 kJ•mol-1,故C正确;
D.强酸强碱的中和热为-57.3 kJ/mol,而Ba(OH)2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l)反应过程包括中和热和沉淀热,△H不是114.6 kJ,故D错误;
故选C.
点评 本题考查了热化学方程式的书写及应用,题目难度中等,明确燃烧热、中和热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 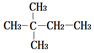 | B. | 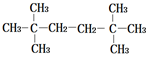 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
| A. | 铝粉的作用是点燃时可以置换出氧气 | |
| B. | 在反应中NH4ClO4仅起到氧化剂作用 | |
| C. | 该反应属于分解反应,也属于氧化还原反应 | |
| D. | 上述反应瞬间能产生高温,高温是推动飞船飞行的主要因素 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 氯原子的结构示意图: | B. | 氯化镁的电子式: | ||
| C. | N2的电子式: | D. | 氯化氢分子的形成过程: |
 请回答下列问题:
请回答下列问题: