题目内容
20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图变化规律(图中a表示转化率,φ表示体积分数,p表示压强,T表示温度,n表示物质的量),根据以上规律图象,下列总结的反应特点结论不全面的是( )| A. | 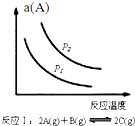 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |
分析 A.反应Ⅰ说明升高温度,A的转化率降低,增大压强平衡向正反应方向移动;
B.反应Ⅱ由图象可以看出T1>T2,升高温度C的物质的量减少;
C.反应Ⅲ中温度的高低与温度对平衡移动的影响有关;
D.反应Ⅳ,由图象可以看出T2条件下A的转化率大,分别根据T2>T1或T2<T1讨论.
解答 解:A.反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图象,压强增大A的转化率应增大,所以p2>p1,它随温度的升高A的转化率降低,所以正反应为放热反应△H<0,故A正确;
B.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,故B正确;
C.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故C错误;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,当T2>T1时,说明升高温度平衡向正反应方向进行,因此正反应为吸热反应△H>0;当T2<T1时,说明升高温度平衡向逆反应方向进行,因此正反应为放热反应△H<0,故D正确;
故选C.
点评 本题考查外界条件对化学平衡的影响,题目难度中等,本题注意分析图象中曲线的变化趋势,结合方程式的特征以及外界条件对平衡移动的影响分析,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.常温下,分别将四块形状相同,质量均为6g的铁块同时投入下列四种溶液中,产生氢气气体速率最快的是( )
| A. | 200mL 2mol/L HCl | B. | 500mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
11.在5L密闭容器中充入X(g),发生反应X(g)═Y(g)+Z(g)△H,所得实验数据如表:
下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(Z) | n(Y) | ||
| ① | 600 | 1 | 0 | 0 | 0.8 |
| ② | 600 | 0.1 | a | 0.9 | 0.8 |
| ③ | 600 | 0 | 1.5 | 1.5 | b |
| ④ | 500 | 0.5 | 1.2 | 1.0 | c |
| A. | 实验②起始时V(逆)<v(正)且a=0.9 | |
| B. | 600℃时,该反应平衡常数K=3.2 moI/L | |
| C. | 实验③中b<1.2 | |
| D. | 若b>c,则△H<O |
8.科学研究、工业生产和日常生活都离不开物质的制备.
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变填(“增大”、“减小”或“不变”).
(2)下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为3.00×10-3mol/(L.S).
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol/L,则T2<T1(填“>“、“<”或“=”).
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)BaSO4与碳在高温下反应生成一氧化碳与金属硫化物,该反应中每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.(Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变填(“增大”、“减小”或“不变”).
(2)下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol/L,则T2<T1(填“>“、“<”或“=”).
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)BaSO4与碳在高温下反应生成一氧化碳与金属硫化物,该反应中每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.(Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
15.一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应:C(s)+CO2(g)?2CO(g),反应平衡时,体系中气体体积分数与温度的关系如图所示.下列说法正确的是( )
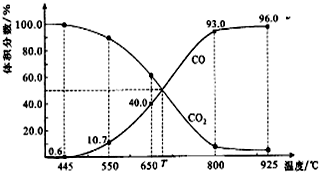

| A. | 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为吸热反应 |
5.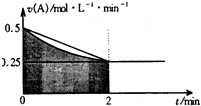 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
 请回答下列问题:
请回答下列问题: