题目内容
17.如表为元素周期表的一部分,列出了10种元素在元素周期表中的位置.试回答下列问题:
(1)写出表中⑥含有8个中子的原子的化学符号146C,元素⑦的氢化物与⑧的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
(2)元素⑩的核外电子排布式1s22s22p63s23p63d64s2.
(3)根据元素周期表来比较④和Cs的金属性,要通过另一种元素作中介或桥梁进行比较,这种元素是Na或Ba(填元素符号).
(4)据报道,美国科学家卡尔•克里斯特于1998年11月根据①合成了一种名为“N5”的物质,由于其极强的爆炸性,又称“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键,则“N5”分子碎片的电子式为:
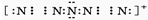 .
.
分析 由元素在周期表的位置可知,①~⑩分别为N、Na、K、Mg、Al、C、O、Cl、I、Fe,
(1)⑥含有8个中子的原子为C原子,质量数为14;元素⑦的氢化物与⑧的单质反应生成盐酸和HClO;
(2)Fe的原子序数为26;
(3)比较④和Cs的金属性,结合同周期从左向右金属性减弱、同主族从上到下金属性增强分析;
(4)“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键,中间N原子上有2对孤对电子.
解答 解:由元素在周期表的位置可知,①~⑩分别为N、Na、K、Mg、Al、C、O、Cl、I、Fe,
(1)表中⑥含有8个中子的原子的化学符号为146C,元素⑦的氢化物与⑧的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:146C;Cl2+H2O=H++Cl-+HClO;
(2)Fe的原子序数为26,核外电子排布式为1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(3)因同周期从左向右金属性减弱、同主族从上到下金属性增强,则比较④和Cs的金属性,可选择Na或 Ba作中介或桥梁进行比较,
故答案为:Na或 Ba;
(4)“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键,中间N原子上有2对孤对电子,其电子式为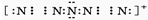 ,故答案为:
,故答案为: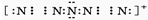 .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素化合物知识、电子排布、金属性比较为解答的关键,侧重分析与应用能力的考查,注意(4)为解答的难点,题目难度不大.

练习册系列答案
相关题目
8.科学研究、工业生产和日常生活都离不开物质的制备.
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变填(“增大”、“减小”或“不变”).
(2)下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为3.00×10-3mol/(L.S).
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol/L,则T2<T1(填“>“、“<”或“=”).
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)BaSO4与碳在高温下反应生成一氧化碳与金属硫化物,该反应中每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.(Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变填(“增大”、“减小”或“不变”).
(2)下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol/L,则T2<T1(填“>“、“<”或“=”).
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)BaSO4与碳在高温下反应生成一氧化碳与金属硫化物,该反应中每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.(Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
5.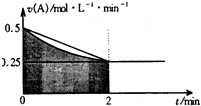 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
2.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应为吸热反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a< b (填“>”、“<”或“=”).
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a< b (填“>”、“<”或“=”).
6.有关油脂的说法,错误的是( )
| A. | 油脂是人体不可缺少的营养物质 | |
| B. | 油脂的水解产物是氨基酸 | |
| C. | 油脂主要在小肠中被消化吸收 | |
| D. | 脂肪中多不饱和酸含量越高,其营养价值也越高 |
7.2009年9月25日,我国成功发射“神舟七号”载人飞船.飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为:2NH4ClO4═N2↑+Cl2↑+2O2↑+4H2O.下列有关叙述正确的是( )
| A. | 铝粉的作用是点燃时可以置换出氧气 | |
| B. | 在反应中NH4ClO4仅起到氧化剂作用 | |
| C. | 该反应属于分解反应,也属于氧化还原反应 | |
| D. | 上述反应瞬间能产生高温,高温是推动飞船飞行的主要因素 |
 请回答下列问题:
请回答下列问题: