题目内容
7. 运用化学原理研究元素及其化合物的反应有重要意义.
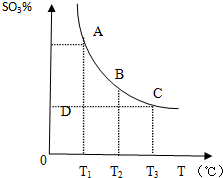
运用化学原理研究元素及其化合物的反应有重要意义.(1)硫酸生产中SO2催化氧化生成SO3的反应为:2SO2(g)+O2(g)?2SO3(g),反应混合体系中SO3的平衡百分含量和温度的关系如图所示,据此回答下列问题:
①若在恒温、恒压条件下向上述平衡体系中通入氦气,正反应速率减小(填“增大”“减小”或“不变”);平衡的移动方向是逆向(填“正向”或“逆向”).
②温度为T1时反应进行到状态D时,平衡的移动方向是正向(填“正向”或“逆向”).
(2)工业生产中既要生产合格的产品,又要考虑生产过程的经济效益.
①为了提高成本较高的SO2的利用率,可采取的措施有bce.
a.升高温度 b.降低温度 c.增大n(O2)与 n(SO2)之比
d.减小n(O2)与 n(SO2)之比 e.增大压强 f.减小压强
②实际生产中选择的条件是常压下,按n(SO2)与 n(O2)之比为1:1.6投料,简述选择这一条件的理由增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以SO2的催化氧化采用常压而不是高压;增大氧气浓度从而提高二氧化硫的转化率.
分析 (1)①若在恒温、恒压条件下向上述平衡体系中通入氦气,容器体积增大,则反应物和生成物分压减小,减小压强正逆反应速率都减小,平衡向气体体积增大的方向移动;
②温度为T1时反应进行到状态D时,该温度下要使该反应达到平衡状态,需要三氧化硫含量增大才能实现;
(2)①为了提高SO2的利用率,应该使平衡正向移动,但不能通过增大二氧化硫浓度实现;
②增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,增大氧气物质的量能提高二氧化硫转化率.
解答 解:(1)①若在恒温、恒压条件下向上述平衡体系中通入氦气,容器体积增大,则反应物和生成物分压减小,减小压强正逆反应速率都减小,平衡向气体体积增大的方向移动,即向逆反应方向移动,
故答案为:减小;逆向;
②温度为T1时反应进行到状态D时,该温度下要使该反应达到平衡状态,需要三氧化硫含量增大才能实现,平衡正向移动,故答案为:正向;
(2)①a.升高温度,三氧化硫含量降低,说明平衡逆向移动,不能提高二氧化硫利用率,故错误;
b.降低温度,三氧化硫含量增大,平衡正向移动,提高二氧化硫利用率,故正确;
c.增大n(O2)与 n(SO2)之比,平衡正向移动,提高二氧化硫利用率,故正确;
d.减小n(O2)与 n(SO2)之比,平衡逆向移动,不能提高二氧化硫利用率,故错误;
e.增大压强,平衡正向移动,提高二氧化硫利用率,故正确;
f.减小压强,平衡逆向移动,降低二氧化硫利用率,故错误;
故选bce;
②增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以采用常压;增大氧气物质的量能提高二氧化硫转化率,所以采用n(SO2)与 n(O2)之比为1:1.6投料,
故答案为:增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以SO2的催化氧化采用常压而不是高压;增大氧气浓度从而提高二氧化硫的转化率.
点评 本题考查化学平衡移动影响因素,为高频考点,侧重考查学生分析判断能力,明确浓度、温度、压强对化学平衡移动影响原理是解本题关键,注意恒温恒容条件下充入稀有气体、恒温恒压条件下充入稀有气体区别,题目难度不大.

| A. | N2→NH3 | B. | MgCl2→MgSO4 | C. | Cu→CuO | D. | FeO→Fe |
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
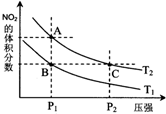
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.(1)一定温度下,反应2NO2(g)?N2O4 (g)△S<0,该反应能自发进行的原因是△H<0(选填“=”、“>”、“<”)
(2)对反应2NO2(g)?N2O4(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②2NO2(g)?N2O4(g)该反应的平衡常数K的值为2.8;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正>v逆(填“>”、“<”或“=”),升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
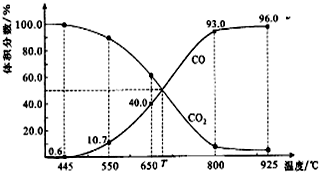
| A. | 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为吸热反应 |
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
| X | Y | ||
| Z | W | M |
(1)X元素名称碳,W的离子结构示意图
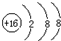 ;
;(2)元素Z位于周期表中的位置是第三周期第VA族;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称白磷或红磷;
(4)Y的最高价氧化物的化学式为N2O5;M的最高价氧化物水化物名称为高氯酸;
(5)Z、W、M三种元素中,原子半径最大的是P(填元素符号);这三者与氢元素形成的化合物中,最稳定的是HCl(填:氢化物的化学式),它的电子式为
 ;
;(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是共价键(填:“离子键”或“共价键”)
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化.则在该条件下A不能完全转化为B(填:“能”或“不能”)
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
(1)已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1
C(石墨,s)+CO2(g)=2CO(g)△H2
则△H=△H1-3△H2(用含△H1、△H2代数式表示)
(2)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是B(填字母).
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
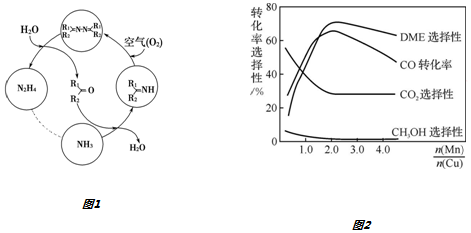
II.利用空气催化氧化法制取联氨,其有关物质的转化如图1所示(R1、R2代表烃基).
①在图1示的转化中,化合价不变的一种元素是氢或H.
②反应中当有1mol NH3转化为N2H4时,保持溶液中酮的物质的量不变,需要消耗O2的物质的量为0.25mol.
③在温度一定和不补加溶液的条件下,缓慢通入NH3、O2混合气体,并充分搅拌.欲使生成的N2H4中不含NH3,可采取的措施有增大混合气体中氧气的含量.
Ⅲ.采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察如图2回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.
| A. | 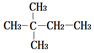 | B. | 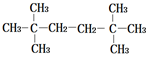 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
 请回答下列问题:
请回答下列问题: