题目内容
12.经测定某微粒有与H2S拥有相同的电子数,它不可能是( )| A. | HCl | B. | HS- | C. | NH2- | D. | Ca2+ |
分析 共价化合物所含电子数等于构成原子所含电子数的总和,阴离子所含电子数为构成原子所含电子数的总和+电荷数,阳离子所含电子数为构成原子所含电子数的总和-电荷数.
解答 解:H2S拥有相同的电子数为1×2+16=18,
HCl拥有相同的电子数为1+17=18,
HS-拥有相同的电子数为1+16+1=18,
NH2-拥有相同的电子数为7+1×2+1=10,
Ca2+拥有相同的电子数为20-2=18,
故选C.
点评 本题考查了微粒所含电子数的计算,难度不大,掌握化合物、阴离子和阳离子的电子数的计算方法是关键.

练习册系列答案
相关题目
2.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | 生铁>钠>纯铁 |
3.与27.0克H2O含有相同中子数的D2O质量为( )
| A. | 13.2g | B. | 20.1g | C. | 22.0g | D. | 24.0g |
7.一些元素的排列(表中数字为原子序数),根据现行的周期表合理的是( )
| A. |
| B. |
| C. |
| D. |
|
17.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
| A. | Na2CO3 | B. | Na2O2 Na2CO3 | ||
| C. | NaOH Na2CO3 | D. | Na2O2 NaOH Na2CO3 |
4.某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
实验方案:该小组设计如图所示装置实验(夹持仪器已略去,装置气密性完好)
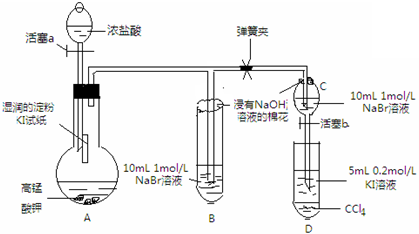
实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |

实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
1.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA | |
| D. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
2.在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
则下列说法中正确的是( )
| 物质 | A | B | C | D |
| 反应前质量(g) | 4 | 6 | 111 | 4 |
| 反应后质量(g) | 待测 | 15 | 0 | 84 |
| A. | 该反应的反应物为A和C | |
| B. | 容器中发生的化学反应,属于分解反应 | |
| C. | 反应后,生成了84g D物质 | |
| D. | 反应后,待测A的质量为26 g |