题目内容
2.在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:| 物质 | A | B | C | D |
| 反应前质量(g) | 4 | 6 | 111 | 4 |
| 反应后质量(g) | 待测 | 15 | 0 | 84 |
| A. | 该反应的反应物为A和C | |
| B. | 容器中发生的化学反应,属于分解反应 | |
| C. | 反应后,生成了84g D物质 | |
| D. | 反应后,待测A的质量为26 g |
分析 B的质量增大15g-6g=9g,D的质量增大84g-4g=80g,则B、D为生成物,C的质量减少111g,C为反应物,由于111g>9g+80g=89g,故A为生成物,根据质量守恒定律可以计算生成A的质量,可得反应后A的总质量.
解答 解:B的质量增大15g-6g=9g,D的质量增大84g-4g=80g,则B、D为生成物,C的质量减少111g,C为反应物,由于111g>9g+80g=89g,故A为生成物.
A.该反应中反应物为C,生成物为A、B、D,故A错误;
B.一种物质反应生成三种物质,属于分解反应,故B正确;
C.反应后生成D的质量为84g-4g=80g,故C错误;
D.根据质量守恒定律,生成A的质量为111g-89g=22g,则反应后,待测A的质量为4g+22g=26 g,故D正确.
故选:BD.
点评 本题考查化学方程式计算,涉及质量守恒定律的应用,比较基础,注意从宏观的质量角度与微观原子角度理解质量守恒定律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.经测定某微粒有与H2S拥有相同的电子数,它不可能是( )
| A. | HCl | B. | HS- | C. | NH2- | D. | Ca2+ |
13.从柑橘中炼制的萜二烯其结构简式为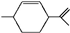 .有关萜二烯的说法不正确的是( )
.有关萜二烯的说法不正确的是( )
 .有关萜二烯的说法不正确的是( )
.有关萜二烯的说法不正确的是( )| A. | 萜二烯的分子式为C10H16,不属于芳香烃 | |
| B. | 可溶于乙醇或乙醚,不溶于水 | |
| C. | 萜二烯分子中所有碳原子处于同一个平面上 | |
| D. | 萜二烯与过量的溴的四氯化碳溶液反应后的产物为 |
17.下列各组物质中,都是强电解质的是( )
| A. | HBr、HCl、BaSO4 | B. | NH4Cl、CH3COONa、Na2S | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、NaF、Ba(OH)2 |
7.工业上使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图1:
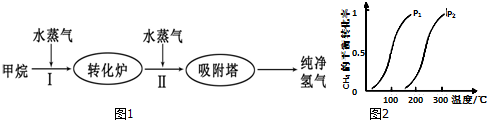
(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),
一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2(填“<”、“>”或“=”).
100℃时,将1mol CH4和2mol H2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-4.
(2)此流程的第II步反应的平衡常数随温度的变化如下表:
从上表可以推断:该反应是放热反应(填“吸热”或“放热”).
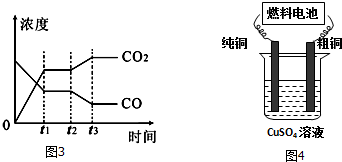
图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,图中t2时刻发生改变的条件是降低温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
(3)工业上常利用第Ⅰ步反应产生的CO和H2在“催化反应室”中合成二甲醚(CH3OCH3).在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1kJ/mol.
(4)用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(见图4),在接通电路一段时间纯铜质量增加6.4g.
请写出燃料电池中的正极反应式:O2+2H2O+4e-=4OH-.
燃料电池正极消耗空气的体积是5.6L(标准状况,空气中O2体积分数以20%计算).

(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),
一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2(填“<”、“>”或“=”).
100℃时,将1mol CH4和2mol H2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-4.
(2)此流程的第II步反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,图中t2时刻发生改变的条件是降低温度,或增加水蒸汽的量,或减少氢气的量(写出一种).

(3)工业上常利用第Ⅰ步反应产生的CO和H2在“催化反应室”中合成二甲醚(CH3OCH3).在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1kJ/mol.
(4)用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(见图4),在接通电路一段时间纯铜质量增加6.4g.
请写出燃料电池中的正极反应式:O2+2H2O+4e-=4OH-.
燃料电池正极消耗空气的体积是5.6L(标准状况,空气中O2体积分数以20%计算).
14.下列物质的类别与所含官能团都表达错误的是( )
| A. | 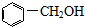 醇类-OH 醇类-OH | |
| B. | CH3CH2CH2COOH 羧酸-COOH | |
| C. | 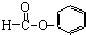 醛类-CHO 醛类-CHO | |
| D. | CH3-O-CH3 醚类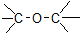 |
11.据报道,铀是一种放射性元素,23592U是核电站的主要燃料.下列关于23592U的说法正确的是( )
| A. | 质量数为235 | B. | 质子数是235 | ||
| C. | 中子数为92 | D. | 与23892U是同种原子 |
12.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 | |
| B. | 如果发生氯气泄漏,附近人员应迅速远离液氯泄漏地点,并顺风往低洼区域疏散 | |
| C. | “低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 | |
| D. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |