题目内容
20.某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥.纯净的氯气.为防止换集气瓶时生成的氯气污染空气,设计了如下装置: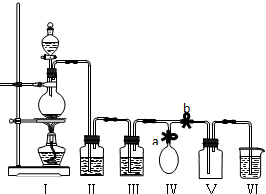
(1)写出Ⅰ装置烧瓶中发生的反应的离子方程式:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O.浓盐酸的作用是酸性和氧化性
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是除HCl;装置Ⅲ的作用是干燥氯气,应盛放浓H2SO4.
(3)烧杯中应放NaOH溶液来处理氯气,反应的离子方程式是:Cl2+2OH-═Cl-+ClO-+2H2O.
分析 实验室用加热二氧化锰与浓盐酸的方法制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,要得到干燥纯净的氯气,应依次通过盛有饱和食盐水和浓硫酸的洗气瓶分别除去氯化氢和水蒸气,氯气密度大于空气密度,采用向上排气法收集,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用盛有氢氧化钠溶液吸收过量的氯气.
(1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,依据反应方程式中氯元素化合价变化判断盐酸的作用;
(2)浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入集气瓶前,应该用饱和食盐水和浓硫酸分别除去氯化氢和水蒸气;
(3)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用盛有氢氧化钠溶液吸收过量的氯气.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,离子方程式:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O,依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知参加反应的氯化氢有4mol,只有2mol氯离子化合价升高,另外2mol氯离子化合价不变,所以浓盐酸既表现酸性又表现还原性;
故答案为:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O;酸性和氧化性;
(2)浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入集气瓶前,应该用饱和食盐水和浓硫酸分别除去氯化氢和水蒸气;
故答案为:除HCl; 浓H2SO4;
(3)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-═Cl-+ClO-+2H2O,可以用盛有氢氧化钠溶液吸收过量的氯气;
故答案为:NaOH溶液; Cl2+2OH-═Cl-+ClO-+2H2O.
点评 本题考查了实验室制备氯气的方法和原理分析,氯气性质的分析应用,掌握基础是关键,题目难度不大.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 化学能转化成光能 | B. | 化学能转化成电能 | ||
| C. | 光能转化成化学能 | D. | 电能转化成光能 |

| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物比X的氢化物稳定 | |
| D. | Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 |

| A. | V2=400mL | |
| B. | 0≤V1<280mL | |
| C. | 加入NaOH溶液的过程中,产生沉淀的最大量可能为0.18mol | |
| D. | 当V1=160mL时,n(Mg)=0.04mol |
| A. | 盐酸 | B. | FeCl3溶液 | C. | 溴水 | D. | 四氯化碳 |
| A. | HCl | B. | HS- | C. | NH2- | D. | Ca2+ |
| A. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | 温度为298 K时,pH<7 |