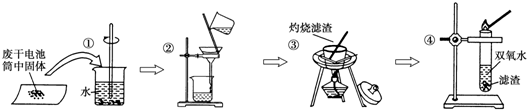
题目内容
2.下列物质的熔、沸点高低顺序正确的是( )| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | 生铁>钠>纯铁 |
分析 A.原子晶体中,熔沸点与键长成反比;
B.分子晶体中熔沸点与其相对分子质量成正比;
C.NH3、H2O、N2、CO均为分子晶体,若能形成分子间氢键,熔沸点反常的升高;若不能形成分子间氢键,则相对分子质量越大,分子间作用力越强,熔沸点越高;若相对分子质量相同,分子的极性越强,熔沸点越高;
D.一般来说,合金熔沸点高于纯金属,金属晶体熔沸点与金属键成正比,金属键与原子半径成反比,与电荷成正比.
解答 解:A.原子晶体中,熔沸点与键长成反比,这几种物质都是原子晶体,键长:C-C<C-Si<Si-Si,所以熔沸点金刚石>二氧化硅>碳化硅>晶体硅,故A错误;
B.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越大,则熔、沸点为CI4>CBr4>CCl4>CF4,故B正确;
C.NH3、H2O、N2、CO均为分子晶体,若能形成分子间氢键,熔沸点反常的升高;若不能形成分子间氢键,则相对分子质量越大,分子间作用力越强,熔沸点越高;若相对分子质量相同,分子的极性越强,熔沸点越高,氨气和水均能形成分子间氢键,但水中的氢键比氨气强得多,N2和CO相对分子质量相等,但一氧化碳为极性分子,而氮气为非极性分子,熔沸点高低顺序为H2O>NH3>CO>N2,故C错误;
D.熔、沸点:金属钠的金属键比铁弱,合金的熔点比纯金属的低,则熔、沸点为纯铁>生铁>钠,故D错误;
故选B.
点评 本题考查晶体熔沸点高低判断,明确晶体类型及晶体熔沸点影响因素是解本题关键,注意分子晶体熔沸点与范德华力和氢键有关,题目难度不大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
3. 松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )
 松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )| A. | 松油醇的分子式为C10H18O | |
| B. | 松油醇能发生加成反应、消去反应、氧化反应、酯化反应 | |
| C. | 松油醇存在酚类的同分异构体,分子中有2个手性碳原子 | |
| D. | 松油醇分子在核磁共振氢谱中有9个吸收峰 |
10.某中学生利用水果设计了一套原电池装置.原电池的能量转化方式是( )
| A. | 化学能转化成光能 | B. | 化学能转化成电能 | ||
| C. | 光能转化成化学能 | D. | 电能转化成光能 |
14.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是( )
①钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色
②KI溶液中加入淀粉溶液会变成蓝色
③溴水中加入CCl4振荡静置后,CCl4层无色.
①钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色
②KI溶液中加入淀粉溶液会变成蓝色
③溴水中加入CCl4振荡静置后,CCl4层无色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
11.表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )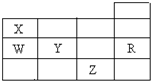

| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物比X的氢化物稳定 | |
| D. | Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 |
12.经测定某微粒有与H2S拥有相同的电子数,它不可能是( )
| A. | HCl | B. | HS- | C. | NH2- | D. | Ca2+ |