题目内容
关于3Cl2+6KOH
KClO3+5KCl+3H2O反应,以下说法错误的是( )
| ||
| A、Cl2既是氧化剂,又是还原剂 |
| B、3 mol氯气参加反应转移5 mol电子 |
| C、氧化产物的物质的量是还原产物的物质的量的5倍 |
| D、每有1 mol原子被氧化的同时就有5 mol原子被还原 |
考点:氧化还原反应
专题:
分析:3Cl2+6KOH
KClO3+5KCl+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
| ||
解答:
解:A.该反应中只有Cl元素的化合价变化,则氯气既是氧化剂又是还原剂,故A正确;
B.由化合价变化可知,3mol氯气参加反应转移5mol电子,故B正确;
C.由反应可知,1molCl被氧化,5molCl被还原,则被还原的氯元素的质量为被氧化的氯元素质量的5倍,则还原产物的物质的量是氧化产物的物质的量的5倍,故C错误;
D.Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,则根据电子守恒可知1molCl被氧化,5molCl被还原,故D正确;
故选C.
B.由化合价变化可知,3mol氯气参加反应转移5mol电子,故B正确;
C.由反应可知,1molCl被氧化,5molCl被还原,则被还原的氯元素的质量为被氧化的氯元素质量的5倍,则还原产物的物质的量是氧化产物的物质的量的5倍,故C错误;
D.Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,则根据电子守恒可知1molCl被氧化,5molCl被还原,故D正确;
故选C.
点评:本题考查氧化还原反应,把握反应中的元素化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
下列物质属于含有共价键的离子化合物的是( )
| A、NH4Cl |
| B、Na2O |
| C、Al2O3 |
| D、SO3 |
关于分散系和胶体的说法正确的是( )
| A、胶体、溶液、浊液都是分散系 |
| B、粒子的半径:浊液>溶液>胶体 |
| C、可见光通过溶液时,产生丁达尔现象 |
| D、胶体都不透明,且稳定性极强 |
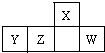 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下: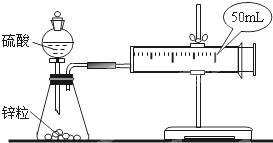 两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间. 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.