题目内容
 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)该反应逆反应的化学平衡常数表达式为K=
(2)上述正反应方向是
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图,则0~4min的平均反应速率v(CO)=
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于
②反应在4min~5min,平衡向逆方向移动,可能的原因是
A.增加水蒸气B.降低温度 C.使用催化剂D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol?L-1,在该条件下,CO的最大转化率为:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积解答;
(2)根据平衡常数随温度的变化进行判断;
(3)根据v=
计算反应速率;
(4)根据浓度、压强、温度对平衡移动的影响分析;
(5)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算.
(2)根据平衡常数随温度的变化进行判断;
(3)根据v=
| △c |
| △t |
(4)根据浓度、压强、温度对平衡移动的影响分析;
(5)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算.
解答:
解:(1)CO(g)+H2O(g)?H2(g)+CO2(g)逆反应为:H2(g)+CO2(g)?CO(g)+H2O(g),平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,故K=
,故答案为:
;
(2)升高温度,平衡常数减小,平衡逆向移动,故正反应为放热反应,故答案为:放热;
(3)v(CO)=
=(0.2-0.08)÷4=0.03mol/(L?min),故答案为:0.03mol/(L?min);
(4)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡,另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,
故答案为:平衡;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选D.
表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选A,
故答案为:D;A;
(5)设CO的浓度变化量为c,则
CO(g)+H2O(g)?H2(g)+CO2(g),
起始:0.02 0.02 0 0
转化:c c c c
平衡:0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=
=
=9,解得c=0.015,
CO的最大所以转化率为
×100%=75%,
故答案为:75%.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)升高温度,平衡常数减小,平衡逆向移动,故正反应为放热反应,故答案为:放热;
(3)v(CO)=
| △c |
| △t |
(4)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡,另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,
故答案为:平衡;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选D.
表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选A,
故答案为:D;A;
(5)设CO的浓度变化量为c,则
CO(g)+H2O(g)?H2(g)+CO2(g),
起始:0.02 0.02 0 0
转化:c c c c
平衡:0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c×c |
| (0.02-c)×(0.02-c) |
CO的最大所以转化率为
| 0.015 |
| 0.2 |
故答案为:75%.
点评:本题主要考查化学平衡常数、反应速率的计算、平衡移动的影响因素、转化率等知识,题目难度中等,注意平衡常数只受温度的影响,注意(5)中利用平衡常数进行转化率的计算.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
下列说法正确的是( )
| A、糖类、油脂和蛋白质是基本营养物质 |
| B、蛋白质水解的最终产物是多肽 |
| C、糖尿病人不能食用含糖和淀粉的食品 |
| D、向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
已知25℃、101kPa下,拆开1mol C-H键要吸收415kJ的能量,拆开1mol C-C键要吸收331kJ的能量,拆开1mol O2中的O═O键要吸收498kJ的能量,形成水分子中的1mol H-O键要放出465kJ的能量,形成二氧化碳分子中的1mol C═O键要放出798kJ的能量.在丙烷燃烧过程中不考虑其他能量转化,下列说法正确的是( )
| A、丙烷完全燃烧的热化学方程式为C3H8+5O2═3CO2+4H2O△H=-2 036 kJ/mol |
| B、C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H<-2 036 kJ/mol |
| C、丙烷完全燃烧的热化学方程式为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=2 036 kJ/mol |
D、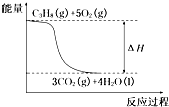 丙烷燃烧的能量变化可用如图所示表示 |
关于3Cl2+6KOH
KClO3+5KCl+3H2O反应,以下说法错误的是( )
| ||
| A、Cl2既是氧化剂,又是还原剂 |
| B、3 mol氯气参加反应转移5 mol电子 |
| C、氧化产物的物质的量是还原产物的物质的量的5倍 |
| D、每有1 mol原子被氧化的同时就有5 mol原子被还原 |
你认为下列数据可信的是(已知1nm=10-9m)( )
| A、某元素的原子半径是0.160 nm |
| B、某常见气体的密度为1.8 g/cm3 |
| C、某澄清石灰水的浓度是4.0 mol/L |
| D、某溶液中溶质的质量分数120% |
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.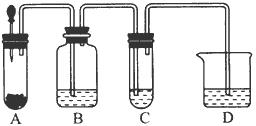 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)