题目内容
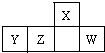 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
考点:元素周期律和元素周期表的综合应用
专题:
分析:由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,结合元素周期律及其单质化合物的性质来解答.
解答:
解:由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,
A.同周期随原子序数增大,原子半径减小,电子层越多,原子半径越大,则原子半径为Y>Z>W>X,故A错误;
B.Y为Al,属于金属元素,而Z为Si,属于非金属元素,故B错误;
C.同周期自左而右元素非金属性增强,故非金属性W>Z,非金属性越强,氢化物越稳定,则最简单气态氢化物的热稳定性为W>Z,故C错误;
D.X为氮元素,它的氢化物能与其最高价氧化物对应的水化物分别为NH3、HNO3,二者形成形成化合物NH4NO3,故D正确,
故选D.
A.同周期随原子序数增大,原子半径减小,电子层越多,原子半径越大,则原子半径为Y>Z>W>X,故A错误;
B.Y为Al,属于金属元素,而Z为Si,属于非金属元素,故B错误;
C.同周期自左而右元素非金属性增强,故非金属性W>Z,非金属性越强,氢化物越稳定,则最简单气态氢化物的热稳定性为W>Z,故C错误;
D.X为氮元素,它的氢化物能与其最高价氧化物对应的水化物分别为NH3、HNO3,二者形成形成化合物NH4NO3,故D正确,
故选D.
点评:本题考查结构性质位置关系应用,W为推断的突破口,侧重元素周期律的考查,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
关于3Cl2+6KOH
KClO3+5KCl+3H2O反应,以下说法错误的是( )
| ||
| A、Cl2既是氧化剂,又是还原剂 |
| B、3 mol氯气参加反应转移5 mol电子 |
| C、氧化产物的物质的量是还原产物的物质的量的5倍 |
| D、每有1 mol原子被氧化的同时就有5 mol原子被还原 |
你认为下列数据可信的是(已知1nm=10-9m)( )
| A、某元素的原子半径是0.160 nm |
| B、某常见气体的密度为1.8 g/cm3 |
| C、某澄清石灰水的浓度是4.0 mol/L |
| D、某溶液中溶质的质量分数120% |
已知:HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol; HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol.则HCN在水溶液中电离的△H等于( )
| A、+43.5 kJ/mol |
| B、-67.7 kJ/mol |
| C、+67.7 kJ/mol |
| D、-43.5 kJ/mol |
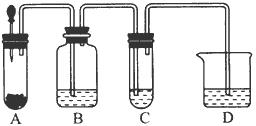 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)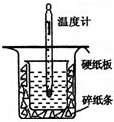 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题 实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题: