题目内容
某烃经李比希元素分析实验测得碳的质量分数为83.3%,氢的质量分数为16.7%,其相对分子质量为72,该烃的核磁共振氢谱如图所示,请通过计算确定该烃的分子式 ,结构简式 .


考点:有机物实验式和分子式的确定
专题:有机物分子组成通式的应用规律
分析:质量分数与摩尔质量的比值相当于原子的物质的量,据此确定原子个数比值,求出最简式;
根据相对分子质量结合最简式计算出该有机物的化学式;
由该烃的核磁共振氢谱可知,核磁共振氢谱只有1个峰,分子中只有1种H原子,结合分子式书写结构简式.
根据相对分子质量结合最简式计算出该有机物的化学式;
由该烃的核磁共振氢谱可知,核磁共振氢谱只有1个峰,分子中只有1种H原子,结合分子式书写结构简式.
解答:
解:N(C):N(H)=
:
=5:12,故该烃的最简式为C5H12;
令组成为(C5H12)n,则72n=72,解得n=1,故该分子式为C5H12;
由该烃的核磁共振氢谱可知,核磁共振氢谱只有1个峰,分子中只有1种H原子,故该烃为结构简式为: ,
,
故答案为:C5H12; .
.
| 83.3% |
| 12 |
| 16.7% |
| 1 |
令组成为(C5H12)n,则72n=72,解得n=1,故该分子式为C5H12;
由该烃的核磁共振氢谱可知,核磁共振氢谱只有1个峰,分子中只有1种H原子,故该烃为结构简式为:
 ,
,故答案为:C5H12;
 .
.
点评:本题考查有机物分子式及结构式的确定等,难度不大,本题注意利用有机物各元素的质量分数计算原子个数比值,求出最简式.

练习册系列答案
相关题目
恒温恒压下,在容积可变的密闭容器中发生反应:A(g)+B(g)?C(g).若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是( )
| A、若开始通入3mol A和3mol B,达到平衡后将生成3a mol C | ||
| B、若开始通入3mol A、2mol B和1mol C,达到平衡后密闭容器中C的物质的量可能为3mol | ||
| C、若开始时通入2mol A、2mol B和1mol C,达到平衡时,B的物质的量一定小于2mol | ||
D、若开始时通入2molA、2mol B和1mol C,达到平衡后,再通入2 mol C,则再次到达平衡后,C的物质的量分数为
|
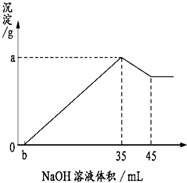 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度( )
| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1.0 mo1?L-1的Na2CO3溶液中:c(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3->c(CO32-)>c(H2CO3) |
| D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) |
10mL 1mol?L-1盐酸与一小块大理石的化学反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
| A、加入一定量的CaCl2 |
| B、加入5 mL 1.5 mol?L-1盐酸 |
| C、加入15 mL 0.5 mol?L-1盐酸 |
| D、加入5 mL H2O |
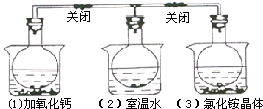 如图所示,三个烧瓶中分别充满NO2气体,并分别放置在盛有下列物质的烧杯中(烧杯内有水):在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
如图所示,三个烧瓶中分别充满NO2气体,并分别放置在盛有下列物质的烧杯中(烧杯内有水):在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )| A、烧瓶(3)中气体的压强增大 |
| B、NH4Cl溶于水时放出热量 |
| C、烧瓶(1)中平衡时混合气体的平均相对分子质量增大 |
| D、2NO2?N2O4是放热反应 |
