题目内容
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1.0 mo1?L-1的Na2CO3溶液中:c(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3->c(CO32-)>c(H2CO3) |
| D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.碳酸根离子结合两个氢离子形成碳酸,质子守恒中碳酸的系数应该为2;
B.混合液显示酸性,则c(H+)>c(OH-),根据电荷守恒判断溶液中离子大小;
C.碳酸氢钠溶液显示碱性,则碳酸氢根离子的水解程度大于其电离程度,所以c(CO32-)<c(H2CO3);
D.溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可得c(NH4+)<2c(SO42-).
B.混合液显示酸性,则c(H+)>c(OH-),根据电荷守恒判断溶液中离子大小;
C.碳酸氢钠溶液显示碱性,则碳酸氢根离子的水解程度大于其电离程度,所以c(CO32-)<c(H2CO3);
D.溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可得c(NH4+)<2c(SO42-).
解答:
解:A.1.0 mol?L-1的Na2CO3溶液中,存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故A错误;
B.醋酸和醋酸钠的混合液显示酸性,则醋酸的电离程度大于醋酸根的水解程度,c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.碳酸氢钠溶液显示碱性,则c(H+)<c(OH-),由于碳酸氢根离子部分水解,则c(Na+)>c(HCO3-),由于碳酸氢根离子的水解程度大于其电离程度,则c(CO32-)<c(H2CO3),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中,c(H+)>c(OH-),根据电荷守恒c(H+)+c(NH4+)=2c(SO42-)+c(OH-)可得:c(NH4+)<2c(SO42-),故D正确;
故选D.
B.醋酸和醋酸钠的混合液显示酸性,则醋酸的电离程度大于醋酸根的水解程度,c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.碳酸氢钠溶液显示碱性,则c(H+)<c(OH-),由于碳酸氢根离子部分水解,则c(Na+)>c(HCO3-),由于碳酸氢根离子的水解程度大于其电离程度,则c(CO32-)<c(H2CO3),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中,c(H+)>c(OH-),根据电荷守恒c(H+)+c(NH4+)=2c(SO42-)+c(OH-)可得:c(NH4+)<2c(SO42-),故D正确;
故选D.
点评:本题考查了离子浓度大小比较、盐的水解原理,题目难度中等,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒、物料守恒来分析解答.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
当下列各组物质的总物质的量保持不变时,组内各成分以任意比例混合充分燃烧,消耗O2的量和生成的CO2的量都不变的是( )
| A、乙烯 乙醛 |
| B、乙炔 乙二醇 |
| C、甲烷 甲醇 |
| D、甲烷 乙醇 |
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、.0.1mol?L-1 pH=7.82的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) |
| B、浓度均为0.1mol?L-1的NH3?H2O溶液和NH4Cl溶液等体积混合:[c(NH4+)+c(H+)]>[c(NH3?H2O)+c(OH-)] |
| C、0.1mol?L-1Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D、0.1mol?L-1Na2S溶液与0.1mol?L-1 NaHS溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S) |
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为( )
| A、0.2mol |
| B、0.6mol |
| C、0.8mol |
| D、1.0mol |
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )


| A、铜片上有气泡逸出 |
| B、溶液的SO42-浓度逐渐减小 |
| C、电子由铜片经导线流向锌片 |
| D、该装置能将电能转化为化学能 |

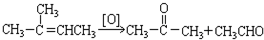
 在上述类似条件下发生反应,请写出反应的方程式:
在上述类似条件下发生反应,请写出反应的方程式: