题目内容
18.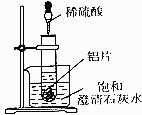 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.回答下列问题:
(1)写出试管中发生反应的离子方程式:2Al+6H+═2Al3++3H2↑;
(2)证明铝和稀硫酸的反应是放热反应的现象是烧杯中饱和的澄清石灰水变浑浊.
由实验可知,2Al+3H2SO4═Al(SO4)3+3H2↑中,1 mol Al2(SO4)3 和3 mol H2的能量总和小于(填“大于”“小于”或“等于”)2 mol Al和3 mol H2SO4的能量总和.
(3)有同学认为,用浓硫酸替代稀硫酸,也可以观察到上述现象.他的观点是否正确?否,简述理由:浓硫酸溶于水放热.
分析 (1)铝和稀硫酸反应生成硫酸铝和氢气;
(2)氢氧化钙的溶解度随着温度的升高而降低,烧杯中饱和的澄清石灰水变浑浊;反应物的能量高于生成物的能量时,反应是放热反应;
(3)浓硫酸溶于水放热.
解答 解:(1)试管中铝和稀硫酸反应:2Al+3H2SO4═Al(SO4)3+3H2↑,离子反应为:2Al+6H+═2Al3++3H2↑,
故答案为:2Al+6H+═2Al3++3H2↑;
(2)由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状,说明铝和稀硫酸的反应是放热反应,当反应物的能量高于生成物的能量时,反应是放热反应,故1 mol Al2(SO4)3 和3 mol H2的能量总和小于2 mol Al和3 mol H2SO4的能量总和,
故答案为:烧杯中饱和的澄清石灰水变浑浊;小于;
(3)用浓硫酸替代稀硫酸,观察到烧杯中饱和的澄清石灰水变浑浊,不一定为铝和稀硫酸的放热反应,因浓硫酸溶于水放热,故他的观点不正确,
故答案为:否;浓硫酸溶于水放热.
点评 本题主要考查的是常见的放热反应,并将化学变化与氢氧化钙的溶解度有机结合起来,考查了学生运用知识的能力,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
8.下列说法不正确的是( )
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | 2015 年 10 月,中国科学家屠呦呦获得诺贝尔生理学或医学奖,以表彰她从青蒿中提取了青蒿素(C15H22O5),这种药品可以有效降低疟疾患者的死亡率 | |
| D. | 原子吸收光谱仪一般用于测定物质中的非金属元素,红外光谱仪可用于测定有机化合物中的官能团 |
9.下列说法正确的是( )
| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 室温下,pH均为3的盐酸和NH4Cl溶液中,水的电离程度相同 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
13.常温下,下列微粒能在相应溶液中大量共存的是( )
| A. | 稀硫酸中:K+、MnO4-、CH3CH2OH | |
| B. | pH=10的溶液中:Na+、SO32-、NH3•H2O | |
| C. | 中性溶液中:Na+、NO3-、AlO2- | |
| D. | FeCl3溶液中:H2O2、Mg2+、SO42- |
3.己知反应2H2(g)+02(g)=2H20(1)△H=-285.8kJ•mo1-1,下列正确的是( )
| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
10.下列说法中,正确的是( )
| A. | 放热的自发过程都是熵值减小的过程 | |
| B. | 吸热的自发过程常常是熵值增加的过程 | |
| C. | 水自发地从高处流向低处,是趋向能量最低状态的倾向 | |
| D. | 只根据焓变来判断化学反应的方向是可以的 |
14.下列表达式正确的是( )
| A. | CH3COOH溶液中CH3COOH的电离:CH3COOH=H ++CH3COO- | |
| B. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- | |
| C. | NaHCO3溶液中HCO3-的水解:HCO3-+H2 O?H3 O ++CO32- | |
| D. | 将FeCl3溶液滴入Na2CO3溶液中:2Fe3++3 CO32?+3 H2 O═2Fe(OH)3↓+3 CO2↑ |
15.已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
| A. | △H=+488.3 kJ•mol-1 | B. | △H=-244.15 kJ•mol-1 | ||
| C. | △H=-977.6 kJ•mol-1 | D. | △H=-488.3 kJ•mol-1 |