题目内容
9.下列说法正确的是( )| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 室温下,pH均为3的盐酸和NH4Cl溶液中,水的电离程度相同 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
分析 A.电解熔融MgCl2产生1 mol Mg,转移2mol电子;
B.原电池的正极被保护,属于牺牲阳极的阴极保护法;
C.酸碱抑制水的电离,能水解的盐促进水的电离;
D.达到平衡时,不同物质的正逆反应速率之比等于计量数之比.
解答 解:A.电解熔融MgCl2产生1 mol Mg,转移2mol电子,理论上转移的电子数约为2×6.02×1023,故A正确;
B.原电池的正极被保护,负极被腐蚀,Fe、Zn形成原电池时,Fe作正极被保护,属于牺牲阳极的阴极保护法,故B正确;
C.pH均为3的盐酸抑制水的电离,NH4Cl促进水的电离,所以pH均为3的盐酸和NH4Cl溶液中,水的电离程度不相同,故C错误;
D.达到平衡时,不同物质的正逆反应速率之比等于计量数之比,则一定条件下反应2SO2+O2?2SO3达到平衡时,2v正(O2)=v逆(SO3),故D错误.
故选AB.
点评 本题考查了电解和电子数的计算、金属的腐蚀和防护、影响水的电离平衡的因素、化学平衡状态的判断等,题目难度不大,侧重于基础知识的考查,注意把握酸碱盐对水的电离平衡的影响.

练习册系列答案
相关题目
19.2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:下列说法不正确的是( )
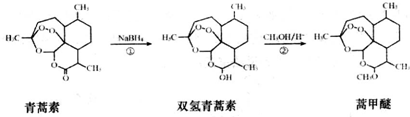

| A. | 青蒿素的分子式是C15H22O5,属于烃的衍生物 | |
| B. | 青蒿素难溶于水,而易溶于有机溶剂 | |
| C. | 反应②为取代反应,有H2O生成 | |
| D. | 青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基 |
20.我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质-青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法正确的是( )

| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | ①、②的反应类型分别为还原反应、酯化反应 | |
| C. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| D. | 双氢青蒿素与蒿甲醚组成上相差-CH2-,二者互为同系物 |
17.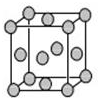 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
(1)TY2是一种常用的溶剂,是非极性分子(填“极性分子”或“非极性分子”),分子中存在2个σ键.W的最简单氢化物容易液化,理由是氟化氢分子之间存在着氢键.
(2)在25℃、101kPa下,已知13.5g的X固体单质在O2中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号为M;该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的电负性由大到小的顺序为F>O>S(用元素符号作答).
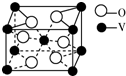
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g•cm-3,则晶胞边长为$\root{3}{4.72×1{0}^{-23}}$(用含立方根的式子表示);
ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3.Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:
Z+HCl+O2=ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂B.HO2是氧化产物
C.HO2在碱中能稳定存在D.1mol Z参加反应有1mol 电子发生转移.
 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(2)在25℃、101kPa下,已知13.5g的X固体单质在O2中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号为M;该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的电负性由大到小的顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g•cm-3,则晶胞边长为$\root{3}{4.72×1{0}^{-23}}$(用含立方根的式子表示);
ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3.Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:
Z+HCl+O2=ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂B.HO2是氧化产物
C.HO2在碱中能稳定存在D.1mol Z参加反应有1mol 电子发生转移.
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、NH4+、SO42-、CO32- | |
| B. | 与铝反应产生大量氢气的溶液中:Ca2+、Fe2+、Cl-、NO3- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-6的溶液中:K+、Na+、I-,SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液中:Na+、K+、S2-、SO42- |
 钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.
钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.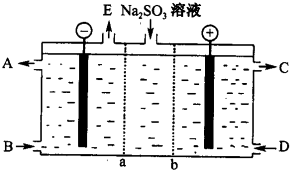
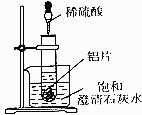 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.