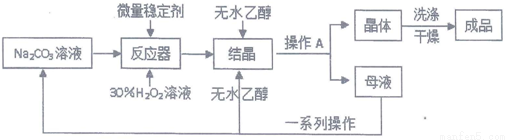
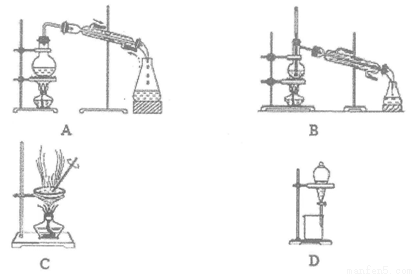
题目内容
4.本世纪是生命科学研究的昌盛时期,科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基.一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护.人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物.NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量.某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1.
(1)请根据测定原理写出有关反应的离子方程式NH2OH+2O2-+H+=NO2-+H2O2+H2O;
(2)计算该样品此时c(O2-)=5.000×10-3mol/L;
(3)如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
①请写出其测定原理的反应方程式2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
②测定所用的主要玻璃仪器为酸式滴定管、锥形瓶,滴定终点的现象为:锥形瓶中的溶液显浅紫色,且半分钟内不褪色.
分析 (1)根据题中信息结合质量守恒定律书写化学方程式;
(2)根据离子方程式中c(O2-)与c(N02-)的计量数关系计算;
(3)①根据MnO4-的氧化性和H2O2的还原性结合质量守恒定律和电荷守恒书写离子方程式;
②根据实验原理,用KMnO4标准溶液进行滴定过氧化物,则用酸式滴定管量取过氧化物于锥形瓶中,再用装有KMnO4标准溶液的酸式滴定管进行滴定,所以测定所用的主要玻璃仪器为酸式滴定管、锥形瓶;高锰酸钾呈紫红色,本身具有颜色,无需加指示剂,反应进行完全则溶液呈无色.
解答 解:(1)O2-与羟胺(NH2OH)在弱酸性环境中反应生NO2-和一种过氧化物,由质量守恒可知过氧化物为H2O2,有关反应的离子方程式:NH2OH+2O2-+H+=NO2-+H2O2+H2O;
故答案为:NH2OH+2O2-+H+=NO2-+H2O2+H2O;
(2)根据反应式:NH2OH+2O2-+H+=NO2-+H2O2+H2O,c(NH2OH):c(O2-)=1:2,则c(O2-)=2×2.500×1O-3mol/L=5.000×10-3mol/L;
故答案为:5.000×10-3mol/L;
(3)①MnO4-具有氧化性,H2O2具有还原性,二者发生氧化还原反应生成Mn2+和O2,离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
②根据实验原理,用KMnO4标准溶液进行滴定过氧化物,则用酸式滴定管量取过氧化物于锥形瓶中,再用装有KMnO4标准溶液的酸式滴定管进行滴定,所以测定所用的主要玻璃仪器为酸式滴定管、锥形瓶;高锰酸钾呈紫红色,本身具有颜色,无需加指示剂,完全反应溶液呈无色,所以当锥形瓶中的溶液显浅紫色,且半分钟内不褪色即为滴定终点;
故答案为:酸式滴定管、锥形瓶;锥形瓶中的溶液显浅紫色,且半分钟内不褪色.
点评 本题较为综合,以信息题目的形式呈现,考查物质的组成和含量的测定,注意氧化还原方程式的书写,具有一定难度.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 空气的只要作用是提供氧气作氧化剂 | |
| B. | 电解法中ClO2在阴极发生的电极反应式为:ClO2+Na++e-=NaClO2 | |
| C. | 吸收法中加入H2O2主要是做还原剂 | |
| D. | 从环保的角度考虑,电解法比吸收法更环保 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )
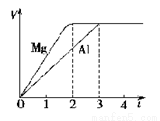
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
在100 ℃时,3.88 g 的气体A与足量的Na2O2反应,可放出氧气,且固体的质量增加了2.28 g,由此可知,A的组成为( )
A.只有水蒸气 B.只有二氧化碳 C.水蒸气和二氧化碳 D.无法确定
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
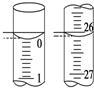
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
| A. | 液态水气化 | B. | Al和Fe3O4的反应 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |