题目内容
17.把一根卷成螺旋状的铜丝在酒精灯火焰上加热,红色的铜丝变成黑色,把它立即插入盛有乙醇的试管中,铜丝表面出现的变化是由黑色变成红色;重复几次同样的操作,试管内液体散发出具有刺激性气味的气体,这是乙醇被氧化而生成乙醛之故.在反应后的试管中加入适量的新制氢氧化铜悬浊液,再加热至沸,可发现试管中的混和物中有红色物质生成.发生该反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.分析 把一根卷成螺旋状的铜丝在酒精灯火焰上加热,铜被空气中氧气氧化生成黑色的氧化铜;氧化铜在加热条件下能够与乙醇发生氧化还原反应生成乙醛和铜,黑色变成红色;生成的有刺激性气味的气体为乙醛;乙醛与新制氢氧化铜浊液反应生成乙酸、氧化亚铜和水.
解答 解:铜能被氧气氧化为黑色氧化铜,氧化铜能将乙醇氧化为乙醛,同时由黑色氧化铜又变成红色铜,金属铜在反应中作催化剂,整个过程的反应为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,C2H5OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O;
在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、水和红色的氧化亚铜,反应方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:黑;由黑色变成红色;氧化;乙醛;红色物质;CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
点评 本题考查了乙醇的催化氧化、化学方程式书写,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握乙醇的催化氧化原理及乙醛与氢氧化铜的反应原理,试题培养了学生的化学实验能力.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
2.胶体区别于其他分散系的本质特征是( )
| A. | 加热会聚沉 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能透过半透膜 | D. | 分散质颗粒大小在1-100nm之间 |
9.关于反应方程式Cl2+2I-═2Cl-+I2,说法不正确的是( )
| A. | Cl2是氧化剂 | B. | I2是还原产物 | ||
| C. | 上述反应属于置换反应 | D. | 上述反应属于离子反应 |
6.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e→2O2-).下列说法不正确的是( )


| A. | c电极的名称为正极,d电极上的电极反应式为CH4-8e-+4O2-═CO2+2H2O | |
| B. | 如图2所示,a电极上的电极反应式为4OH--4e-═2H2O+O2↑ | |
| C. | 如图2所示电解100mL0.5mol/LCuSO4溶液,若a电极产生56mL(标准状况)气体,则所得溶液的pH=1(不考虑溶液体积变化) | |
| D. | 若要使电解质溶液恢复到电解前的状态,可加入Cu2(OH)2CO3 |
7.下列各物质的颜色变化不是由平衡移动引起的是( )
| A. | H2、I2、HI平衡混合气体加压颜色变深 | |
| B. | 氯水光照颜色变浅 | |
| C. | NO2、N2O4混合气体加热颜色变深 | |
| D. | FeCl和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题: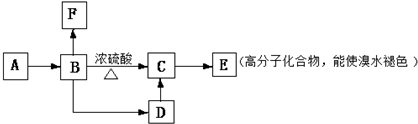
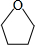 ,
,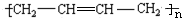 .
.