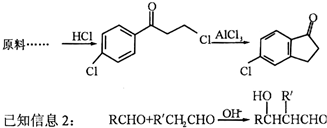
题目内容
7.下列各物质的颜色变化不是由平衡移动引起的是( )| A. | H2、I2、HI平衡混合气体加压颜色变深 | |
| B. | 氯水光照颜色变浅 | |
| C. | NO2、N2O4混合气体加热颜色变深 | |
| D. | FeCl和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A.该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,与平衡移动无关,故A选;B.氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O?HCl+HClO向右移动,故B不选;
C、2NO2?N2O4是放热反应,加热平衡逆向移动,气体颜色变深,故C不选;
D、FeCl和KSCN的混合溶液中加入FeCl3固体,铁离子浓度变大,平衡正向移动,溶液颜色加深,故D不选;
故选A.
点评 本题考查平衡移动原理知识,题目难度不大,注意使用平衡移动原理的前提必须是可逆反应,且是否发生平衡的移动.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
18.关于下图装置,下列说法不正确的是( )
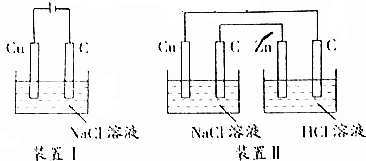

| A. | 装置Ⅰ通电一段时间,可看见溶液变蓝,碳棒上有大量红色物质附着 | |
| B. | 装置Ⅱ能加速铜电极的腐蚀 | |
| C. | 装置Ⅰ将电源换成灵敏电流表,观察到有电流通过 | |
| D. | 装置Ⅰ通电30s后反接电源,再过30s后电极质量未恢复 |
15.浓度均为1mol/L的KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
| A. | 9:6:2 | B. | 9:3:1 | C. | 6:3:2 | D. | 6:3:1 |
12.H2O2是一种二元弱酸,对于0.1mol•L-1的过氧化氢溶液,下列叙述不正确的是( )
| A. | H2O2的电离方程式可写作H2O2?H++HO2-,HO2-?H++O22- | |
| B. | 加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大 | |
| C. | 加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动 | |
| D. | 加入少量氯化铁溶液,溶液中产生大量气泡 |
19.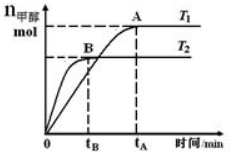 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 该反应在T1时的平衡常数比T2时的大 | |
| C. | 平衡常数K=$\frac{c(CO)•{c}^{2}({H}_{2})}{c(C{H}_{2}OH)}$ | |
| D. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
17.在强酸性的溶液中能大量共存的离子组是( )
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
 .
. .
.