题目内容
5.现将19.2g铜与足量稀硝酸反应,反应后得200mL溶液.计算:(1)生成的气体在标准状况下的体积.
(2)被还原的硝酸的物质的量.
(3)取100mL反应后生成的硝酸铜溶液,加水稀释至0.5mol/L,稀释后硝酸铜溶液的体积.
分析 (1)根据n=$\frac{m}{M}$计算19.2g铜的物质的量,再根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O计算生成的NO的物质的量,根据V=nVm计算生成NO的体积;
(2)被还原的硝酸的物质的量等于一氧化氮的物质的量;
(3)根据铜原子守恒可知n(Cu2+)=n(Cu),再根据c=$\frac{n}{V}$计算,稀释前后溶质的物质的量不变.
解答 解:(1)19.2g铜的物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,则:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2
0.3mol n(NO)
故n(NO)=0.2mol,所以V(NO)=0.2mol×22.4L/mol=4.48L,
答:生成NO的体积为4.48L.
(2)被还原的硝酸的物质的量等于一氧化氮的物质的量为0.2mol,答:被还原的硝酸的物质的量为:0.2mol;
(3)设稀释后硝酸铜溶液的体积为xml,根据铜原子守恒可知n(Cu2+)=n(Cu)=0.3mol,
故c(Cu2+)=$\frac{0.3mol}{0.2L}$=0.15mol/L,则:0.15×100=0.5×x,解之得x=30
答:释后硝酸铜溶液的体积30ml.
点评 本题考查根据方程式的计算、硝酸的性质等,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
15.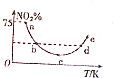 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
16.在短周期元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同.又知三元素最外层电子数之和为14,而质子数之为28.则三种元素有可能是( )
| A. | C、N、P | B. | N、O、S | C. | N、P、F | D. | Be、O、S |
13.甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子分别被苯基和氯原子取代,可得到 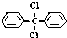 ,对该分子的描述,正确的是( )
,对该分子的描述,正确的是( )
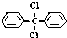 ,对该分子的描述,正确的是( )
,对该分子的描述,正确的是( )| A. | 此分子中存在着6种不同化学环境的氢原子 | |
| B. | 所有碳原子一定都在同一平面上 | |
| C. | 此分子难溶于水 | |
| D. | 此分子属芳香烃类物质 |
20.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol Na2O2与水反应时,转移电子的数目为2 NA | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为7 NA | |
| D. | NA个一氧化碳分子和0.5 molCH4的质量比为7:4 |
14.下列反应属于消去反应的是( )
| A. | 乙酸与甲醇在浓硫酸作用下共热 | B. | 用丙烯与氯化氢反应制氯丙烷 | ||
| C. | 乙醛与银氨溶液共热 | D. | 溴乙烷与NaOH的醇溶液共热 |
15.浓度均为1mol/L的KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
| A. | 9:6:2 | B. | 9:3:1 | C. | 6:3:2 | D. | 6:3:1 |