题目内容
4.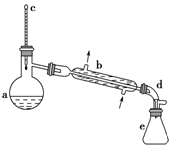 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: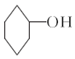 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,可能用到的有关数据如表:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯12g.
回答下列问题:
(1)装置b的名称是直形冷凝管(或冷凝管).
(2)本实验中最容易产生的副产物的结构简式为
 ,生成该物质的反应类型是取代反应
,生成该物质的反应类型是取代反应(3)分液漏斗在使用前须清洗干净并检漏,在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CE(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.分液漏斗D.锥形瓶 E.蒸发皿
(5)本实验所得到的环己烯产率是73.2%.
分析 (1)根据仪器构造可知;
(2)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(4)在环己烯粗产物蒸馏过程中,根据各仪器的作用选取仪器;
(5)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置是直形冷凝管;
故答案为:直形冷凝管(或冷凝管);
(2)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚,副产物的结构简式为 ;
;
故答案为: ;取代反应;
;取代反应;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
故答案为:检漏;上口倒出;
(4)观察题目提供的实验装置图知蒸馏过程中不可能用到分液漏斗和蒸发皿;
故答案为:CE;
(5)环己醇的物质的量=$\frac{20g}{100g/mol}$=0.2mol,根据C原子守恒知,理论上生成环己烯的物质的量也是0.2mol,其质量=0.2mol×82g/mol=16.4g,生成的本实验所得到的环己烯产率=$\frac{12}{16.4}$=73.2%;
故答案为:73.2%.
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及实验操作顺序是解本题关键,注意从实验安全性、评价性、操作规范性等方面分析解答,充分利用题给信息解答问题,题目难度中等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
4.下列分子中既能发生消去反应,又能发生氧化反应的是( )
| A. | CH2CH=CHCH2CH2Cl | B. | CH3OH | ||
| C. |  | D. |  |
15.A、B、C为短周期元素,在周期表中所处的位置如表所示.
A、C两元素的原子核外电子数之和等于B原子的质子数.
(1)写出B、C元素的名称硫、氟.
(2)B位于元素周期表中第3周期第ⅥA族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是H2,质量为0.4g,电解的总反应方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式NH3+HNO3═NH4NO3.
| A | C | |
| B |
(1)写出B、C元素的名称硫、氟.
(2)B位于元素周期表中第3周期第ⅥA族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是H2,质量为0.4g,电解的总反应方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式NH3+HNO3═NH4NO3.
12.元素周期表可以指导人们进行规律性的推测和判断.下列说法不正确的是( )
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
19.1g CH4完全燃烧生成CO2和液态水时放出55.6kJ的热量,该反应的热化学方程式为( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.6 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-55.6 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-889.6kJ•mol-1 |
9.下列化合物中,既有离子键又有共价键的离子化合物是( )
| A. | NH4Cl | B. | MgO | C. | HNO3 | D. | CaCl2 |
16.电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-═ZnO+H2O Ag2O+H2O+2e-═2Ag+2OH-,下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,溶液中OH- 移向正极 | |
| D. | 原电池工作时,溶液中电子由负极流向正极 |
13.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).其中③⑤元素的最高价氧化物对应的水化物发生反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O.
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑧元素与⑥元素形成的化合物高温下灼烧时,火焰呈紫色.如何观察透过蓝色钴玻璃.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).其中③⑤元素的最高价氧化物对应的水化物发生反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O.
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑧元素与⑥元素形成的化合物高温下灼烧时,火焰呈紫色.如何观察透过蓝色钴玻璃.
5. 2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
(1)降冰片烯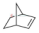 (C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
写出表示降冰片烯标准燃烧热的热化学方程式:C7H10(l)+9.5O2(g)=7CO2(g)+5H2O(l)△H=-3948kJ/mol.
(2)CH3OH和液氧是常用的液体火箭推进剂.
①已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1
2H2(g)+O2(l)═2H2O(l)△H2
CH3OH(g)═CH3OH(l)△H3
2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4
则△H4=3△H2-2△H1-2△H3(用△H1、△H2、△H3来表示).
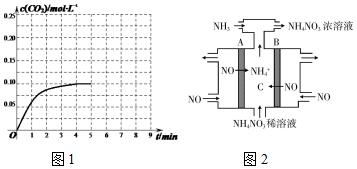
②某温度下,发生反应CO2(g)+3H2(g)?CH3OH (g)+H2O(g).在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数59.26.保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH).请在图中画出5到9min的c(CO2)变化曲线示意图.
(3)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为阴极,请写出在B电极上发生的电极反应式:NO-3e-+2H2O=NO3-+4H+.
 2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.(1)降冰片烯
 (C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂.已知:| 燃料 | 密度(g•cm-3) | 体积热值(J•L-1) |
| 降冰片烯 | 1.0 | 4.2×107 |
(2)CH3OH和液氧是常用的液体火箭推进剂.
①已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1
2H2(g)+O2(l)═2H2O(l)△H2
CH3OH(g)═CH3OH(l)△H3
2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4
则△H4=3△H2-2△H1-2△H3(用△H1、△H2、△H3来表示).
②某温度下,发生反应CO2(g)+3H2(g)?CH3OH (g)+H2O(g).在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数59.26.保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH).请在图中画出5到9min的c(CO2)变化曲线示意图.
(3)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为阴极,请写出在B电极上发生的电极反应式:NO-3e-+2H2O=NO3-+4H+.