题目内容
18.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.83kJ/molCO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(l),并放出114.3kJ热量,则混合气体中CO的物质的量为( )
| A. | 0.1 mol | B. | 0.15 mol | C. | 0.22 mol | D. | 0.05 mol |
分析 根据生成水的质量,利用2H2+O2═2H2O(l)可计算氢气的物质的量,再利用混合气体燃烧放出的热量与氢气燃烧放出的热量来计算CO燃烧放出的热量,最后利用热化学反应方程式来计算CO的物质的量.
解答 解:水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,
由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.3mol,
由H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.83kJ•mol-1可知,0.3molH2燃烧放出的热量为:285.83kJ/mol×0.3mol=85.749kJ,
则CO燃烧放出的热量为:114.03kJ-85.749kJ=28.281kJ,
设混合气体中CO的物质的量为x,则
2CO(g)+O2(g)=2CO2(g)△H=-565.8kJ•mol-1
2 565.8kJ
x 28.281kJ
则:$\frac{2}{x}$=$\frac{565.8kJ}{28.28kJ}$,
解得:x=0.1mol,
即原混合气体中CO的物质的量为0.1mol,
故选A.
点评 本题考查有关反应热的计算、混合物反应的计算,题目难度中等,明确物质的量与热量的正比例关系是解答的关键,试题侧重考查学生的化学计算能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
8.化学与生活密切相关.下列说法不正确的是( )
| A. | 用含增塑剂的聚氯乙烯薄膜作食品包装材料 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 中国古代用明矾溶液的酸性清洗铜镜表面的铜锈 |
6.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 16g臭氧所含的原子数为NA | |
| B. | 22.4LCO气体的物质的量为1mol | |
| C. | CO的摩尔质量为28g | |
| D. | 标准状况下1mol水的体积约为22.4L |
13.下列实验或操作过程中一定有氧化还原反应发生的是( )
| A. | 分离、提纯NaCl与KNO3混合物中的KNO3 | |
| B. | 将NaCl溶液蒸发、结晶转变为NaCl固体 | |
| C. | 用四氯化碳萃取溴水中的溴 | |
| D. | 实验室利用KMnO4与浓盐酸反应制备氯气(Cl2) |
7.下列有关说法,正确的是( )
| A. | SO2的水溶液能导电,说明SO2是电解质 | |
| B. | Al(OH)3有弱碱性,可用于中和胃酸 | |
| C. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 | |
| D. | 明矾和漂白粉常用于自来水的净化和消毒,两者原理相同 |
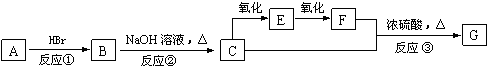
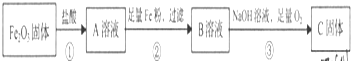
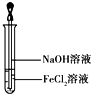 金属及其化合物在人类生产、生产中发挥着重要的作用.
金属及其化合物在人类生产、生产中发挥着重要的作用.