题目内容
18.元素的性质呈现周期性变化的根本原因是( )| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
分析 随原子序数的递增,原子的结构呈现周期性的变化而引起元素的性质的周期性变化,以此来解答.
解答 解:A.因元素的原子半径是元素的性质,不能解释元素性质的周期性变化,故A不选;
B.因元素的化合价属于元素的性质,则不能解释元素性质的周期性变化,故B不选;
C.元素的金属性和非金属性,均为元素的性质,为原子结构周期表变化的必然结果,故C不选;
D.原子的核外电子排布中电子层数和最外层电子数都随原子序数的递增而呈现周期性变化,则引起元素的性质的周期性变化,故D选;
故选D.
点评 本题考查周期表和周期律,为高频考点,把握元素的性质及周期律的实质为解答的关键,侧重分析与应用能力的考查,注意结构决定性质的关系,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
8.下列说法正确的是( )
①苯不能使溴水因反应而褪色证明没有碳碳双键?
②苯分子中碳碳之间的键长均相等证明苯分子无单双键交替结构?
③甲苯是苯的同系物,均不能使酸性高锰酸钾溶液褪色
④间二氯苯没有同分异构体证明了苯分子不是单双键交替
⑤硝基苯中含有苯、浓硝酸、浓硫酸杂质,除杂方法是向其中加入氢氧化钠溶液后分液.
①苯不能使溴水因反应而褪色证明没有碳碳双键?
②苯分子中碳碳之间的键长均相等证明苯分子无单双键交替结构?
③甲苯是苯的同系物,均不能使酸性高锰酸钾溶液褪色
④间二氯苯没有同分异构体证明了苯分子不是单双键交替
⑤硝基苯中含有苯、浓硝酸、浓硫酸杂质,除杂方法是向其中加入氢氧化钠溶液后分液.
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ④⑤ |
9.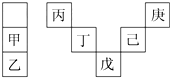 甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物是人类将太阳能转换为电能的常用材料 |
13.38.4克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4升(标准状况),反应消耗的HNO3的物质的量可能是( )
| A. | 1.0摩尔 | B. | 1.6摩尔 | C. | 2.2摩尔 | D. | 2.0摩尔 |
3.下列分子中所有原子都满足最外层8电子稳定结构的是( )
| A. | 二氯化氧(OCl2) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 六氟化氙(XeF6) |
10.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母).
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
、汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母).
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
、汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.

