题目内容
14.二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.(1)下列关于SO2的说法正确的是D.
A.SO2使溴水褪色,体现出SO2的漂白性
B.SO2通入紫色石蕊试液中,先变红后褪色
C.SO2和Cl2混合通入品红溶液,品红一定褪色
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,均会生成白色沉淀
(2)工业上常以SO2为原料制取H2SO4.现用如图所列各装置设计实验,实现碳和浓硫酸的反应并验证各种反应产物:

这些装置的连接顺序(按产物气.流从左至右的方向)是(填装置的编号):
E→D→A→B→A→C
(3)保险粉(Na2S2O4)广泛用于印染行业和食品储存行业.可以将SO2通入草酸钠(Na2C2O4)和足量NaOH的混合溶液中制取保险粉.离子方程式为2SO2+C2O42-+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$S2O42-+2CO32-+2H2O
(4)工业尾气中的SO2可在铜的作用下催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O=2nCuSO4+(2-2n)H2SO4每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为8g.
分析 (1)A.二氧化硫具有还原性,溴单质具有氧化性,二者发生氧化还原反应;
B.二氧化硫水溶液中反应生成亚硫酸显示酸性,二氧化硫的漂白性具有选择性;
C.SO2和Cl2混合通入品红溶液,二者按照1:1恰好反应生成硫酸和盐酸;
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,氨气和二氧化硫发生反应生成亚硫酸铵,结合钡离子生成白色沉淀,二氧化氮具有氧化性能氧化二氧化硫为硫酸;
(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳;
(3)将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液生成Na2S2O4,根据元素守恒可知产物还有碳酸钠和水,根据电荷守恒书写离子方程式;
(4)根据电子得失守恒计算被SO2还原的O2的质量;
解答 解:(1)A.二氧化硫具有还原性,溴单质具有氧化性,二者发生氧化还原反应,SO2+Br2+2H2O=2HBr+H2SO4,体现了二氧化硫的还原性,故A错误;
B.二氧化硫水溶液中反应生成亚硫酸显示酸性,二氧化硫的漂白性具有选择性不能使石蕊试液褪色,故B错误;
C.SO2和Cl2混合通入品红溶液,二者按照1:1恰好反应生成硫酸和盐酸,SO2+Cl2+2H2O=2HCl+H2SO4,不能使品红溶液褪色,故C错误;
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,氨气和二氧化硫发生反应生成亚硫酸铵,结合钡离子生成亚硫酸钡白色沉淀,二氧化氮具有氧化性能氧化二氧化硫为硫酸,硫酸根离子结合钡离子生成硫酸钡白色沉淀,故D正确;
故答案为:D;
(2)木炭粉与浓硫酸发生反应选择固液加热装置选择E,检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在选择D,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,再检验二氧化硫是否除净,选择装置ABA,最后检验二氧化碳,选择C,尾气有毒需进行尾气处理,这些装置的连接顺序(按产物气.流从左至右的方向)是EDABAC,
故答案为:EDABAC;
(3)将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液生成Na2S2O4,根据元素守恒可知产物还有碳酸钠和水,反应的离子方程式为2SO2+C2O42-+4OH- $\frac{\underline{\;\;△\;\;}}{\;}$S2O42-+2CO32-+2H2O,
故答案为:2SO2+C2O42-+4OH- $\frac{\underline{\;\;△\;\;}}{\;}$S2O42-+2CO32-+2H2O;
(4)在反应:2SO2+2n Cu+(n+1)O2+(2-2n) H2O=2n CuSO4+(2-2n) H2SO4 中,每摩尔二氧化硫失去2mol电子,而每摩尔氧气能得到4mol电子,所以1molSO2能还原0.5molO2,每吸收标准状况下11.2L即0.5mol SO2,被SO2还原的O2的质量为0.25mol×32g/mol=8g,
故答案为:8;
点评 本题主要考查元素化合物知识与反应产物的实验检验方案设计、仪器连接顺序,题目难度中等,涉及知识点较多,综合性强,答题时注意元素化合物基础知识和化学原理知识的灵活运用.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | NaOH、H2SO4 | B. | NaOH、CuSO4 | C. | HCl、CuCl2 | D. | NaCl、AgNO3 |
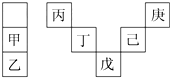 甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物是人类将太阳能转换为电能的常用材料 |

| A. | 该化合物属于芳香烃 | |
| B. | 该化合物分子式为C20H24O2 | |
| C. | 1mol双酚A最多消耗4molBr2 | |
| D. | 双酚A能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 |
| A. | 二氯化氧(OCl2) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 六氟化氙(XeF6) |
 ,则A的结构简式为
,则A的结构简式为 .
.

