题目内容
19.以下物质的制备用错实验装置的是( )| A. |  苯的溴代反应 | B. |  乙酸丁酯的制备 | C. |  苯的硝化反应 | D. |  乙炔的制取 |
分析 A.苯和液溴在溴化铁作催化剂条件下能生成溴苯,溴易挥发且有毒,溴易溶于NaOH溶液中,有缓冲装置的能防止倒吸;
B.在浓硫酸作催化剂、加热条件下丁醇和乙酸发生酯化反应生成乙酸丁酯,用饱和碳酸钠溶液分离乙酸丁酯;
C.苯和浓硝酸在浓硫酸作催化剂、加热55-60℃条件下制取硝基苯;
D.实验室用饱和食盐水和碳化钙固体制取乙炔.
解答 解:A.苯和液溴在溴化铁作催化剂条件下能生成溴苯,溴易挥发且有毒,溴易溶于NaOH溶液中,有缓冲装置的能防止倒吸,苯和液溴是液体、铁是固体,所以可以用分液漏斗和试管作为发生装置,中间装置能防止倒吸,用NaOH溶液吸收挥发的溴和生成的HBr,则可以实现实验目的,故A正确;
B.在浓硫酸作催化剂、加热条件下丁醇和乙酸发生酯化反应生成乙酸丁酯,用饱和碳酸钠溶液分离乙酸丁酯,需要直接加热而不是水浴加热,故B错误;
C.苯和浓硝酸在浓硫酸作催化剂、加热55-60℃条件下制取硝基苯,温度小于100℃,需要水浴加热,故C正确;
D.实验室用饱和食盐水和碳化钙固体制取乙炔,实验可以用分液漏斗盛放液体,用烧瓶盛放碳化钙,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、尾气处理等知识点,明确实验原理、实验操作、物质性质是解本题关键,知道常见仪器的用途,熟悉常见物质制备原理,题目难度不大.

练习册系列答案
相关题目
10.由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
7.某烃甲与氢气反应后的产物乙为(CH3)2CHCH2CH3,则相关说法不合理的是( )
| A. | 产物乙的系统命名为2-甲基丁烷 | |
| B. | 烃甲可能是2-甲基-1,3-丁二烯 | |
| C. | 0.1 mol产物乙完全燃烧可消耗17.92L O2 | |
| D. | 烃甲与乙炔可能是同系物 |
14.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,下列说法正确的是( )
| A. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| B. | 1mol氢气与1mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 在相同条件下,1mol氢气与1 mol氟气的总能量大于2mol氟化氢气体的能量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量 |
8.往NaOH溶液中加入少量的稀醋酸,若温度不变,下列数据一定不变的是( )
| A. | 溶液的质量 | B. | 水的离子积 | C. | OH-物质的量浓度 | D. | 溶液pH值 |
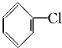 制取
制取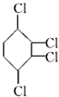 ,其合成流程如下:
,其合成流程如下:
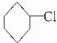 .
. ,
,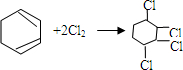 .
. 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: