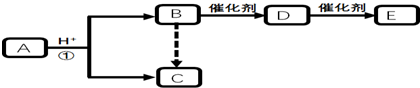
题目内容
11.下列离子方程式与所述事实相符且正确的是( )| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
分析 A.HClO是弱酸,离子方程式中需写化学式;
B.碳酸钙与醋酸反应生成醋酸钙、水、二氧化碳,碳酸钙、醋酸、水、二氧化碳在离子反应中保留化学式;
C.还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-;
D.多元弱酸的酸式盐,分步水解.
解答 解:A.氯气和水反应:Cl2+H2O?H++Cl-+HClO,故A错误;
B.碳酸钙与醋酸反应生成醋酸钙、水、二氧化碳,碳酸钙、醋酸、水、二氧化碳在离子反应中保留化学式,离子反应为CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O,故B错误;
C.11.2 L标准状况下的氯气,Cl2的物质的量为0.5mol,n(FeBr2)=2mol/L×0.2L=0.4mol,根据化学式知,溴化亚铁溶液中n(Fe2+)=n(FeBr2)=0.4mol,n(Br-)=2n(FeBr2)=0.8mol,通入氯气先发生反应2Fe2++Cl2=2Fe3++2Cl-,生成n(Fe3+)=0.4mol,消耗n(Cl2)=0.2mol,Fe2+反应完毕,剩余0.3mol氯气再发生反应2Br-+Cl2═Br2+2Cl-;反应掉0.6molBr-,所以反应为:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl-,故C正确;
D.Na2S是二元弱酸氢硫酸的盐,水解离子方程式为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,故D错误;
故选C.
点评 本题考查离子方程式,侧重于学生的分析能力和元素化合物知识的综合运用的考查,为高考常见题型,注意把握物质的性质,离子方程式的书写必须符合反应的实际,C选项根据亚铁离子、溴离子和氯气之间的关系式计算,明确溶液中离子反应的先后顺序是关键,为易错点,题目难度中等.

| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
| A. | SO3 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
| A. | NaCl溶液 | B. | NaHCO3溶液 | C. | H2SO4溶液 | D. | FeCl3溶液 |
| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
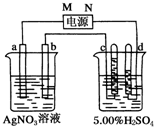 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.