题目内容
1.NA代表阿伏加德罗常数数值,下列有关叙述正确的是( )| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
分析 A、CO和乙烯所处的状态不明确;
B、求出钠的物质的量,然后根据钠和重水反应生成重氢来分析;
C、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
D、溶液体积不明确.
解答 解:A、CO和乙烯所处的状态不明确,故气体的体积无法确定,故A错误;
B、9.2g钠的物质的量n=$\frac{9.2g}{23g/mol}$=0.4mol,而0.4mol钠和重水反应生成0.2mol重氢,故含0.4mol中子即0.4NA个,故B正确;
C、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中氢氧根的物质的量为0.1mol,即0.1NA个,故C错误;
D、溶液体积不明确,故溶液中的铁离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
9.实验式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 1-戊烯和2-甲基-1-丙烯 | B. | 甲醛和甲酸甲酯 | ||
| C. | 1-丁醇和甲乙醚 | D. | 丁酸和乙酸乙酯 |
16.下列有关表述正确的是( )
(1)-OH与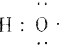 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)sp2杂化轨道:
(3)Fe2+的离子结构示意图: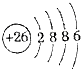
(4)CO2的比例模型图: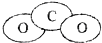
(5)丙烷的分子球棍模型图:
(6)次氯酸的电子式为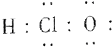
(1)-OH与
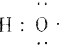 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)sp2杂化轨道:

(3)Fe2+的离子结构示意图:

(4)CO2的比例模型图:

(5)丙烷的分子球棍模型图:

(6)次氯酸的电子式为
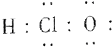
| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5) | D. | (1)(2)(5) |
13.下列实验操作与实验目的或结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将0.1mol•L-1 Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1 Na2SO4溶液,无明显现象 | 证明Ksp(BaSO4)> Ksp(BaCO3) |
| B | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在I3-?I2+I-平衡 |
| C | 向NaAlO2溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
10.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).
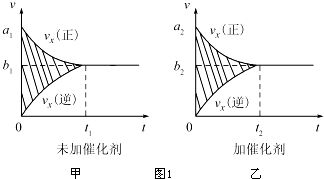
A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
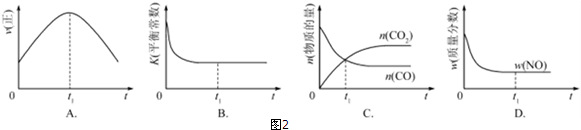
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
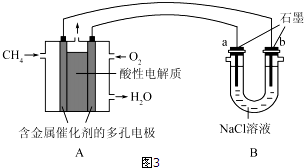
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).

A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
11.下列离子方程式与所述事实相符且正确的是( )
| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |



 .
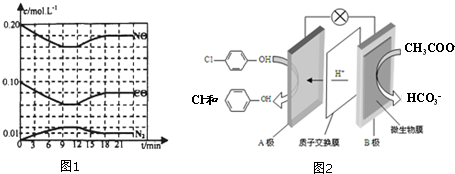
. 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池. )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-