题目内容
2.下列有关说法错误的是( )| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
分析 A.纯碱溶液中碳酸根离子水解显碱性,水解过程是吸热过程,加热促进水解,油脂在碱中水解生成溶于水的物质;
B.根据可燃性气体与空气混合后点燃可能发生爆炸进行分析判断;
C.用无水硫酸铜检验酒精中含有水的过程是硫酸铜和水反应生成硫酸铜晶体;
D.充入氢气遇到明火会发生爆炸,一般是充入氦气.
解答 解:A.纯碱溶液中碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,水解过程是吸热过程,加热促进水解碱性增强,油脂在碱中水解生成溶于水的物质,便于洗去,故A正确;
B.天燃气与空气混合后的气体遇火、电火花、加热易爆炸,打开门窗使气体迅速散发到空气中减小浓度,故B正确;
C.用无水硫酸铜检验酒精中含有水的过程是硫酸铜和水反应生成硫酸铜晶体,发生的是化学反应,故C正确;
D.气球中充入的是氢气,遇到明火会发生爆炸,一般充入惰性气体氦气,故D错误;
故选D.
点评 本题考查了盐类水解、物质性质,注意知识的积累,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
13.下列实验操作与实验目的或结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将0.1mol•L-1 Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1 Na2SO4溶液,无明显现象 | 证明Ksp(BaSO4)> Ksp(BaCO3) |
| B | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在I3-?I2+I-平衡 |
| C | 向NaAlO2溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
10.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).
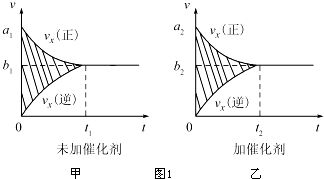
A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
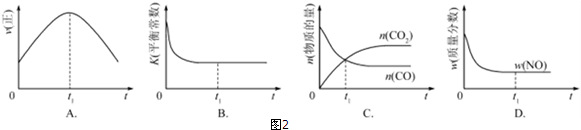
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
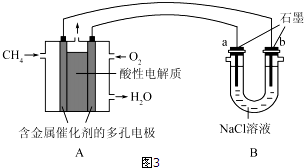
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).

A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
17.下列实验方案设计不合理的是( )


| A. | 图1:验证苯中是否有碳碳双键 | |
| B. | 图2:验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 图3:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 图4:验证酸性CH3COOH>H2CO3>C6H5OH |
7.下列有关物质性质的说法正确的是( )
| A. | 铝与Fe2O3发生铝热反应后固体物质质量不变 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl2═AlCl3+3H2↑可知:2Fe+6HCl2═FeCl3+3H2↑ |
14.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
| A. | 金刚石 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
11.下列离子方程式与所述事实相符且正确的是( )
| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
12.下面有关晶体的叙述中,不正确的是( )
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.